成份
1ml混懸液含100單位(100U)的可溶性門冬胰島素和精蛋白門冬胰島素(相當於3.5mg),比例為30:70。其活性成份為門冬胰島素(通過基因重組技術,利用酵母生產)。
1支筆芯中含3ml,相當於300單位(300U)。
本品以間甲酚和苯酚為抑菌劑,每100ml本品中加入間甲酚0.172g和苯酚0.15g。
其他成份跟:甘油、鋅(氯化物)、氯化鈉、二水合磷酸氫二鈉、硫酸魚精蛋白、氫氧化鈉(pH調節劑)或鹽酸(pH調節劑)和注射用水。
性狀
本品為白色或類白色的混懸液,振盪後應能均勻分散,在顯微鏡下觀察,絕大多數晶體的長度應為1-20μm,晶體寬度不得過3μm。
適應症
用於治療糖尿病 。
規格
100單位/毫升,3毫升/支(筆芯)。
用法用量
本品的用量因人而異,應由醫生根據患者的病情來決定。為了達到理想血糖控制,建議進行血糖監測和胰島素劑量調整。
在2型糖尿病患者中,本品可以作為單一療法治療。對於單獨使用口服降糖藥不足以控制血糖的患者,本品可與口服降糖藥合併用藥。
如何起始治療
從未使用過胰島素的患者:在2型糖尿病患者中,本品的推薦起始劑量為早餐前6單位,晚餐前6單位。本品開始時也可每日一次給藥,晚餐前12單位。
如何轉換為本品治療
當患者由雙時相人胰島素轉為本品治療時,最初可採用相同劑量和方案。然後根據個體需要調整劑量。與所有胰島素產品相同,建議在治療轉換以及其後最初數周內加強血糖監測。單獨使用二甲雙胍不足以控制血糖的2型糖尿病患者,本品也可以作為單一療法。
如何強化治療
本品可由每日一次強化至每日兩次治療。本品每日一次使用當劑量達到30單位時,通常推薦轉化為每日兩次給藥,將劑量等分(50:50)在早餐前和晚餐前給藥。
本品由每日兩次轉為每日三次治療:將每日兩次給藥方案的早餐前劑量分到早餐和午餐前給藥,從每日兩次給藥方案轉為每日三次給藥方案。
如何調整劑量
·根據之前3天內最低餐前血糖水平調整本品的劑量。
·在調整餐時注射劑量後需重新測定血糖水平。
·可每周調整一次劑量,直至達到目標HbA1c。
·如近期曾發生低血糖,不可調高劑量。
·如患者增加體力活動、改變日常飲食或伴發其他疾病時,可能需要調整劑量。
建議按下面的劑量調整指南進行劑量調整:
 諾和銳30
諾和銳30
特殊人群
與所有胰島素產品相同,對於特殊人群,應加強血糖監測,並根據個體需要調整本品劑量。
老年患者用藥:本品可用於老年人;但在75歲以上的患者中,本品與口服降糖藥聯合治療的經驗有限。
肝腎損害:腎功能或肝功能損害時,患者對胰島素的需要量可能減少。
兒童用藥:當優先考慮使用預混胰島素時,本品可用於10歲及以上的兒童和青少年。6-9歲兒童臨床數據有限。本品尚未在6歲以下兒童中進行研究。
用法
本品僅可用於皮下注射,絕不可用於靜脈給藥。也不可用於肌內注射。
本品也不可用於胰島素泵。
本品經皮下注射,部位可選擇大腿或腹壁。如方便,也可選擇臀部或三角肌區域。注射點應在同一注射區域內輪換,以降低脂肪代謝障礙風險。像所有胰島素一樣,劑量、注射部位、血流、溫度及運動量均會影響其作用時間。
本品比雙時相人胰島素起效更快,所以一般須緊鄰餐前注射。必要時,可在餐後立即給藥。
處置和其他處理中的特殊注意事項
針頭和本品僅供一人專用。本品不可重新灌裝使用。
重新混勻後的藥液必須呈均勻的白色霧狀,否則不可使用。
應向患者強調本品在使用前應立刻重新混勻的重要性。
不得使用冷凍過的本品。
建議患者每次注射後丟棄針頭。
本品使用注意事項
本品不可重新灌裝使用。
本品應與諾和諾德胰島素注射系統和諾和針配合使用。
如患者同時接受本品和另一個胰島素筆芯治療,應分別使用兩個胰島素注射系統,每個注射系統分別用於注射不同種類的胰島素。
作為預防措施,患者應隨身多配備一支胰島素注射裝置,以防本品丟失或損害而影響用藥。
患者如何使用本品的說明:
不得使用本品的情況:
·如您對門冬胰島素或本品中所含任何其他成份過敏。
·如您可疑大聲低血糖。
·本品不可用於胰島素泵。
·筆芯或含筆芯的裝置墜落、損壞或擠壓。
·如果本品貯藏不當或被冷凍。
·如果本品經混勻操作後不呈均勻的白色霧狀。
·如果混勻操作後筆芯內出現塊狀物,或有呈霜凍狀的白色固體顆粒粘在筆芯底部或瓶壁上
使用本品前
·檢查標籤並確定其中裝有正確類型的胰島素。
·使用前請檢查本品,包括橡皮活塞。如果筆芯已被損壞,或者未使用過的筆芯的橡皮活塞與白色條碼帶分離,即兩者之間出現間隙,請不要使用本品。並請到供應商處更換。更詳細的指導信息見胰島素注射系統使用手冊。
·為防止污染,每次注射時應始終使用新針頭。
·針頭和本品僅供一人專用。
本品用於皮下注射。本品決不能直接靜脈或者肌肉注射。
請保證注射點在同一注射區域內輪換,以降低發生硬結或皮膚損傷風險。患者自行注射的最佳注射部位為:腹壁、大腿前側或上臂。腹壁給藥起效更快。您需要保持定期測量血糖。
胰島素的混勻
當筆芯尚未裝入胰島素注射系統時:
·第一次使用本品前:將筆芯在手掌間滾搓10次,注意保持筆芯水平。將筆芯上下搖動10次,以使筆芯內的玻璃球由一端移動到另一端。重複上述滾搓和搖動動作直至藥液呈均勻的白色霧狀為止。胰島素達到室溫時更易混勻。搖勻後應立即注射。
·此後的每次注射:將裝有筆芯的注射系統上下搖動至少10次,直至藥液呈均勻的白色霧狀為止。搖勻後應立即按下列步驟進行註冊。
請檢查筆芯中至少剩餘12個單位的胰島素,以保證充分混勻。如果剩餘量少於12個單位,請更換新筆芯。
如何注射本品
·本品皮下注射。患者應採用醫生或護士的指導以及胰島素注射系統用戶手冊中描述的注射技巧進行注射。
·注射後針頭應在皮下停留至少6秒,將按鈕按到底,直至針頭拔出。以確保正確注射,並可保證儘可能少的血液回流入針頭或筆芯。
·每次注射後都應卸下並丟棄針頭,不可帶針頭存放。否則藥液可能從針頭漏出而導致劑量不準確。
不良反應
安全性總結
患者使用本品時發生的不良反應主要與胰島素藥理學作用有關。
低血糖是本品治療中最常見的不良反應。低血糖發生的頻率隨患者人群、劑量方案和血糖控制水平的不同而變化。
胰島素治療初始階段,可能發生屈光不正、水腫和注射部位反應(注射部位疼痛、發紅、蕁麻疹、炎症、瘀青、腫脹和瘙癢)。這些反應通常為一過性。快速改善血糖水平控制可能發生急性痛性神經病變,這種症狀通常是可逆的。儘管快速改善血糖控制的胰島素強化治療可能會暫時性惡化糖尿病視網膜病變,但長期改善血糖控制可以降低糖尿病視網膜病變進展風險。
不良反應列表
根據臨床試驗資料、根據MedDRA系統器官分類的不良反應如下所列。不良反應發生的頻率定義如下:十分常見(≥1/10);常見(≥1/100,<1/10);偶見(≥1/1000,<1/100);罕見(≥1/10000,<1/1000);十分罕見(<1/10000);未知(無法根據現有數據估計發生頻率)。
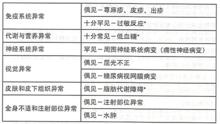 諾和銳30
諾和銳30特定的不良反應描述
過敏反應
全身性過敏反應(症狀可能包括全身性皮疹、瘙癢、出汗、胃腸道不適、血管神經性水腫、呼吸困難、心悸和血壓下降)十分罕見,但有可能危及生命。
低血糖
低血糖是本品治療中最常見的不良反應。如果胰島素使用劑量遠高於需求量,就可能發生低血糖。
嚴重的低血糖可能導致意識喪失和/或驚厥以及暫時性或永久性腦損傷甚至死亡。低血糖症狀通常為突然發生,可能包括出冷汗、皮膚濕冷、疲勞、緊張或顫抖、焦慮、異常疲倦或虛弱、神志不清、注意力集中困難、嗜睡、過度飢餓、視力改變、頭痛、噁心和心悸。臨床試驗表明,低血糖發生的頻率隨患者人群、劑量方案和血糖控制水平的不同而變化。在臨床試驗期間,門冬胰島素與人胰島素相比,低血糖的總體發生率沒有差異。
脂肪代謝障礙
脂肪代謝障礙報告為偶見不良反應。注射部位可能發生脂肪代謝障礙。
禁忌
1)對門冬胰島素或本品中所含任何其他成份過敏。
2)低血糖發作時。
注意事項
特殊警告與使用注意事項
由於在跨時區旅行時,患者要在不同時間使用胰島素和進餐,請在旅行前徵求醫生的意見。
高血糖
本品注射劑量不足或治療中斷時,特別是在1型糖尿病患者中,可能導致高血糖和糖尿病酮症酸中毒。通常,高血糖的最初症狀是在數小時或數日內逐漸發生的,包括口渴、尿頻、噁心、嘔吐、嗜睡、皮膚潮紅、乾燥、口乾、食慾減退以及呼氣有丙酮味。在1型糖尿病患者中,未經治療的高血糖時間最終會導致酮症酸中毒,這可能是致命的。
低血糖
患者漏餐或進行無計畫、高強度的體力活動,可能導致低血糖。
如果胰島素使用劑量遠高於需要量,就可能發生低血糖。
與雙時相人胰島素相比,本品在注射6小時內有更為顯著的降血糖作用。這可能需要根據患者個體情況,通過調整胰島素劑量和/或調整進餐來降低低血糖的風險。
血糖控制有顯著改善的患者(如接受胰島素強化治療的患者),其低血糖的先兆症狀可能會有所改變,應提醒患者注意。病程很長的糖尿病患者中,常見的低血糖先兆症狀可能會消失。
強化血糖控制可能會增加低血糖發作的可能性,因此,在增加劑量過程中需要特別注意。
由於本品緊鄰餐時注射,起效迅速,所以必須同時考慮患者的合併症及合併用藥是否延遲失誤的吸收。
伴有其他疾病時,特別是感染時,通常患者的胰島素需要量會增加。伴發腎臟、肝臟疾病及影響腎上腺、垂體或甲狀腺的疾病,可能需要改變胰島素劑量。
患者換用不同類型的胰島素製劑時,與先前使用的胰島素相比,低血糖的早期先兆症狀可能會有所改變或不太顯著。
由其他胰島素轉為本品治療
患者換用另一種類型或品牌的胰島素製劑的過程,必須在嚴密的醫療監控下進行。以下方面的變化均可能導致劑量改變:胰島素規格、品牌(生產廠)、類型、種類(人胰島素或胰島素類似物)和/或生產工藝。患者從其他胰島素專用本品後,可能需要調整每日注射次數或改變原來的劑量。如果需要調整劑量,則可以在首次給藥時,或者在開始治療的幾周或幾個月內進行調整。
注射部位異常
同所有胰島素治療一樣,使用本品可能發生注射部位異常,包括疼痛、發紅、蕁麻疹、炎症、瘀青、腫脹和瘙癢。在同一注射區域內不斷輪換注射點可能有助於減少和預防此類反應。注射部位反應通常於數日至數周內自行緩解。在很少的病例中,可能因注射部位異常而需中斷本品治療。
噻唑烷二酮類藥物與胰島素聯合
當噻唑烷二酮類藥物與胰島素聯合套用時,曾報告有充血性心力衰竭病例發生,尤其是在有發生充血性心力衰竭危險因素的患者中。當聯合使用噻唑烷二酮類藥物與胰島素類藥品治療時需考慮此種風險的可能性。如將兩種藥物聯合套用,應觀察患者是否出現充血性心力衰竭體徵與症狀,如體重增加和水腫。如發生任何心臟病症狀的惡化,應停用噻唑烷二酮類藥物。
運動員慎用
對駕駛或機械操作能力的影響
低血糖可能會降低患者的注意力和反應能力。這些能力受損,會髒成危險(如在駕駛汽車和操作機械的過程中)。
應特別提醒患者注意避免在駕駛時出現低血糖,尤其是低血糖先兆症狀不明顯或缺乏及既往經常發生低血糖的患者。在上述情況下,應首先考慮患者能否安全操作。
孕婦及哺乳期婦女用藥
本品用於妊娠婦女的臨床經驗還有限。
尚未在妊娠婦女中對本品進行研究。然而,兩項隨機、對照臨床試驗(分別有157例和14例妊娠期患者在基礎-餐時胰島素治療方案中使用門冬胰島素)的數據表明,與可溶性人胰島素相比,門冬胰島素對妊娠或胎兒/新生兒的健康沒有任何不良影響。此外,一項包含27例妊娠期糖尿病婦女的臨床試驗數據顯示,隨機接受門冬胰島素和可溶性人胰島素治療(門冬胰島素14例,可溶性人胰島素13例)的安全性相似。
一般建議患有糖尿病的妊娠婦女在整個妊娠期間和計畫妊娠時採用強化血糖控制和監測的方式治療。胰島素的需要量在妊娠早期通常減少;而在妊娠中、晚期逐漸增加。分娩後胰島素的需要量迅速恢復到妊娠前的水平。
不限制哺乳期婦女使用本品治療。哺乳目前使用胰島素不會對嬰兒產生危害。但是本品的劑量可能需要做相應的調整。
兒童用藥
當預混胰島素為首選藥時,本品可用於10歲及以上的兒童和青少年。6-9歲兒童臨床數據有限。請遵醫囑。
老年用藥
本品可用於老年患者;但在年齡超過75歲的老年患者中,本品與口服降糖藥聯合治療的經驗有限。請遵醫囑。
藥物相互作用
與其他藥物與的相互作用及其他形式的相互作用
已知有許多藥物會影響葡萄糖代謝。
可能會減少胰島素需要量的藥物:
口服抗糖尿病藥物,單胺氧化酶抑制劑(MAOIs),β-受體阻滯劑,血管緊張素轉換酶(ACE)抑制劑,水楊酸鹽,合成類固醇和磺胺類藥物。
可能會增加胰島素需要量的藥物:
口服避孕藥,噻嗪類利尿劑,糖皮質激素,甲狀腺激素,擬交感神經藥,生長激素和達那唑。
β-受體阻滯劑可掩蓋低血糖的症狀。
奧曲肽/蘭瑞肽可能會增加或減少胰島素需要量。
酒精可以增強或減弱胰島素的降糖作用。
藥物過量
對於胰島素藥物過量沒有特別的定義。但是,胰島素過量時會發生不同程度的低血糖反應:
1)對於輕度低血糖反應可採取口服葡萄糖或含糖食物的治療方式。所以,建議糖尿病患者隨身攜帶糖塊、糖果、餅乾、或含糖的果汁。
2) 對於嚴重的低血糖反應,在患者已喪失意識的情況之下,可由受過專業訓練的人員給患者肌肉或皮下注射胰高血糖素(0.5-1.0mg),或由醫務人員給予葡萄糖靜脈注射。如果患者在10-15分鐘之內對胰高血糖素無反應,則必須立即給予葡萄糖靜脈注射。患者神志恢復之後,建議口服碳水化合物以免復發。
藥理毒理
本品為可溶性門冬胰島素(速效胰島素類似物)和精蛋白門冬胰島素(中效胰島素類似物)組成的雙時相混懸液。本品含30%速效門冬胰島素和70%中效門冬胰島素。在摩爾當量的基礎上,門冬胰島素與人胰島素等效價。
作用機制
門冬胰島素的降血糖作用是通過其分子與肌肉和脂肪細胞上的胰島素受體結合後,促進細胞對葡萄糖吸收利用,同時抑制肝臟葡萄糖的輸出來實現的。
本品皮下注射後,將在10-20分鐘內起效。作用最強時間在注射後1-4小時之間。作用持續時間可達24小時。
在一項為期3個月的對比試驗中,1型和2型糖尿病患者於早、晚餐前分別接受本品或雙時相人胰島素30治療,本品可顯著降低餐後血糖水平(早餐和晚餐)。
一項對1型和2型糖尿病患者中開展的9個試驗的Meta分析表明,與雙時相人胰島素30相比,本品早餐前和晚餐前給藥可顯著改善餐後血糖控制(早餐、午餐和晚餐餐後血糖的平均增量)。儘管本品治療患者的空腹血糖較高,但是,根據羰基化血紅蛋白測量,總體血糖控制是相似的。
在一項臨床研究中,341位2型糖尿病患者隨機分組,單獨使用本品治療,或者使用本品與二甲雙胍聯合治療,或者使用二甲雙胍與磺脲類聯合治療。治療16周后,使用本品與二甲雙胍聯合治療的患者和使用二甲雙胍與磺脲類藥物聯合治療的患者相比,主要療效指標糖化血紅蛋白沒有差異。這項臨床研究中,57%的患者基線糖化血紅蛋白在9%以上,在這部分患者當中,使用本品與二甲雙胍聯合治療的患者比使用二甲雙胍與磺脲類聯合治療的患者糖化血紅蛋白下降更為顯著。
在一項研究中,單獨使用口服降糖藥血糖控制不佳的2型糖尿病患者被隨機分為接受本品每日兩次治療(117例患者)或接受甘精胰島素每日一次治療(116例患者)。根據給藥指南的指導接受28周的治療後,使用本品患者的HbA1c平均下降2.8%(基線值為9.7%)。採用本品治療時,分別有66%和42%的患者實現了HbA1c低於7%和6.5%,平均FPG下降大約為7mmol/L(從基線時的14.0mmol/L下降到7.1mmol/L)。
一項Meta分析表明,在2型糖尿病患者中,本品治療時的夜間低血糖發作及重度低血糖發作總風險低於雙時相人胰島素30。在接受本品治療的患者中,日間低血糖發作總風險較高。
兒童和青少年:一項為期16周,共納入167例10-18歲受試者的臨床試驗中,比較了本品(一日三次)餐時給藥與人胰島素(一日兩次)加雙時相人胰島素30(一日一次)餐時給藥對餐後血糖的控制(兩組均可根據血糖情況選擇聯合睡前NPH治療)。其主要結果為:16周治療後(訪視6),本品所在治療組的平均餐後血糖增量比人胰島素/雙時相人胰島素30R組低,但沒有顯著差異。兩組低血糖發生率無差異。
在一項較小型(54例受試者)對更低年齡人群(6-12歲)的雙盲、交叉研究(接受每種治療12周)中發現,本品治療組低血糖發生率與餐後血糖升高幅度均低於雙時相人胰島素30治療組。雙時相人胰島素30治療組終點HbA1c低於本品治療組。
老年患者用藥:尚未在老年患者中進行本品的藥效學特性研究。但一項隨機、雙盲、交叉PK/PD試驗在老年2型糖尿病患者(19例65-83歲患者,平均年齡70歲)中對門冬胰島素與可溶性人胰島素進行了比較。門冬胰島素與可溶性人胰島素在老年患者中的藥效學特性的差異(GIRmax,AUC)與健康受試者和較年輕的糖尿病受試者中觀察到的結果相似。
臨床前安全性資料
非臨床數據表明,根據安全性藥理學、重讀給藥毒性、遺傳毒性和生殖毒性的常規試驗,門冬胰島素對人體沒有特殊危險。在體外試驗中,包括與胰島素和胰島素樣生長因子-1(IGF-1)受體的結合,以及對細胞生長的影響,門冬胰島素的表現與人胰島素非常相似。研究也表明,門冬胰島素和胰島素受體的解離與人胰島素相當。
藥代動力學
門冬胰島素為人胰島素B鏈第28為的脯氨酸由天門冬氨酸代替,所以門冬胰島素形成六聚體的傾向比可溶性人胰島素低。本品中30%由可溶性門冬胰島素組成,與雙時相人胰島素中的可溶性人胰島素相比,皮下吸收更快。另外70%結晶相是精蛋白門冬胰島素,與人NPH胰島素類似,具有較長的吸收作用時間。
本品的最大血清胰島素濃度比雙時相人胰島素30平均高50%。本品達到最大濃度的時間平均是雙時相人胰島素30的一半。在健康人中,經皮下注射本品每公斤體重0.20單位,約在注射60分鐘後,達到最大血清胰島素濃度,平均為140±32pmol/L。本品的半衰期平均為8-9小時,反映魚精蛋白結合部分的吸收率。血清胰島素水平在皮下注射後15-18小時回到基值。對於2型糖尿病患者,給予本品後,達到最大濃度的時間約為95分鐘,持續時間不少於14小時。
老年患者用藥:尚未在老年患者中進行關於本品的藥代動力學特性研究。但老年2型糖尿病患者(65-83歲,平均年齡70歲)中門冬胰島素與可溶性人胰島素的藥代動力學特性相對差異與健康受試者和較年輕的糖尿病受試者中觀察到的結果相似。在老年受試者中觀察到吸收率下降,導致濃度達峰時間延長(82(四分位間距為60-120)分鐘),但最大濃度與較年輕的2型糖尿病受試者相似,略低於1型糖尿病受試者。
肝腎損害:尚未在肝腎損害的患者中進行本品的藥代動力學研究。但在不同程度腎功能和肝功能損害患者中,隨劑量增加,可溶性門冬胰島素的藥代動力學無變化。
兒童和青少年:尚未在兒童或青少年中進行本品的藥代動力學研究。但在兒童(6-12歲)和青少年(13-17歲)1型糖尿病患者中研究過可溶性門冬胰島素的藥代動力學和藥效學特性。在這兩個年齡組中,門冬胰島素均迅速吸收,達峰時間與成人相似。但不同年齡組最大濃度存在差異,強調門冬胰島素個體化劑量調整的重要性。
貯藏
貯藏特別注意事項
尚未使用的本品:應冷藏於2-8℃的冰櫃中(勿接近冰櫃的冷凍室)。不可冷凍。
有效期標註於標籤和包裝盒。
首次使用時,應指導患者在將本品從冰櫃中取出後,建議在達到室溫後再重新混勻。
使用中的本品或隨身攜帶的備用品:已經開啟使用或攜帶備用的本品不要放於冰櫃保存,可在室溫下(不超過 30℃)存放4周。
請將本品置於外包裝紙盒中避光保存。
本品貯藏中必須避免高溫和過度光照。
包裝
筆芯由1型玻璃製成,一端使用橡膠活塞密封,另一端使用不含乳膠的橡膠膜密封,裝有3ml混懸液。筆芯內含有玻璃球以幫助混勻胰島素。每盒1支。
有效期
24個月。
執行標準
進口藥品註冊標準JS20100074
批准文號
進口藥品註冊證號:S20090097
分包裝批准文號:國藥準字J20100037
生產企業
丹麥諾和諾德公司
包裝企業
諾和諾德(中國)製藥有限公司
核准日期
2007年01月31日
修訂日期
2008年01月11日 2009年09月30日
妊娠分級
FDA妊娠分級:B

