成份
本品主要成份為培門冬酶, 培門冬酶為左旋門冬醯胺酶與一定數量的活化態聚乙二醇(PEG)5000通過共價結合而製得的酶製劑。本品所用起始原料門冬醯胺酶生產菌為大腸桿菌(E.coli)。
所屬類別
化藥及生物製品>>治療腫瘤的藥物>>抗腫瘤藥物>>細胞毒性藥物
性狀
本品為無色澄明液體,微有乳光。
適應症
本品適用於急性淋巴細胞白血病(ALL),這種病人治療中需要L-天門冬醯胺酶,若已對天然L-天門冬醯胺酶產生過敏,可試用本品。一般本品與其它化療藥物並用,如長春新鹼(oncovin)、甲氨蝶呤,阿糖胞苷,柔紅黴素和阿黴素。只有在確認多種化療藥物不適用時才可單用本品。本品的療效已證實與天然L-天門冬醯胺酶類似。對天然L-天門冬醯胺酶十分嚴重過敏反應的病人,也能耐受本品。本品也已在非何杰金氏淋巴瘤和急性骨髓性白血病被評價。然而目前還不是指定的適應症。
規格
注射劑:每小瓶5ml,含本品3750IU。
用法用量
本品可肌注或靜滴。以肌注的過敏性或其它不良反應發生率較低。
本品每14天1次,2500IU/平方米。兒童體表面積小於0.6平方米,劑量按每14天82.5 IU/kg。本品的作用持續時間長,比用天然L-天門冬醯胺酶的劑量小,給藥次數少。本品肌注,單次給藥容量應限於2ml,如果> 2ml,應使用多處部位注射。靜脈給藥時,本品應以100ml生理鹽水或5%葡萄糖液稀釋後連續滴注1~2小時。
不良反應
過敏反應:
在觀察的126例病人中,本品肌肉內注射過敏反應的發生率為天然L-天門冬醯胺酶過敏者的30%,而對天然L-天門冬醯胺酶不過敏的病人為11%。
套用本品治療,有時胰腺炎暴發是致命的,已有1%的病人發生。
在臨床試驗中有4%的病人發生血栓形成。
已經發生輕到重度高血糖病人,約3%的人需胰島素控制。已觀察到A-LT、AST和膽紅素升高。 另有噁心和/或嘔吐、發熱和不適。
禁忌
以下患者禁用:
1.對培門冬酶有嚴重過敏史患者。
2.既往使用左旋門冬醯胺酶治療出現過急性血栓症者。
3.既往使用左旋門冬醯胺酶治療出現胰腺炎患者。
4.既往使用左旋門冬醯胺酶治療出現嚴重出血事件者。
注意事項
警告
本品必須在有腫瘤化療經驗以及對本品有使用經驗的醫生指導下進行治療。應儘可能使用同一廠家生產的產品。如需更換,應慎重考慮不同產品之間可能存在的差異,請與企業聯繫,謹遵醫囑使用。
①過敏性反應和急性過敏反應
接受培門冬酶治療的患者可能發生急性過敏反應;尤其有過左旋門冬醯胺酶過敏史的患者幾率更高。給藥後應在復甦裝置及其他必備條件下(例如腎上腺素,氧氣,靜脈注射類固醇,抗組胺藥)觀察1小時以防發生過敏反應。患者發生嚴重急性過敏反應時應停止給藥,給予抗組胺藥物、腎上腺素、氧氣和靜脈內注射類固醇等救治措施。
②血栓 嚴重血栓現象,包括矢狀竇血栓可能發生在培門冬酶給藥患者身上。發生時應停止使用該藥。
③胰腺炎 給予培門冬酶可發生胰腺炎。可以腹部疼痛作為胰腺炎的徵兆。發生時停止使用該藥。
④葡萄糖耐量降低 給予培門冬酶可發生葡萄糖耐量降低,且某些情況下是不可逆的。
⑤凝血障礙 給予培門冬酶的患者或可發生凝血酶原時間延長,部分凝血活酶時間延長,低纖維蛋白原血症等凝血相關現象。給藥期及給藥後應定期檢測相關凝血參數是否超過基線。對於有急性凝血徵兆的患者在給藥前套用新鮮冷凍的血漿替代凝血因子。
使用注意事項:
1本品冷凍結冰後不能使用。冷凍後藥物的外觀雖然沒有明顯的改變,但是藥物的活性已經消失。
2 使用前通過肉眼檢查顆粒物質、 混濁和變色。如發現溶液中有微粒、渾濁、污點、須扔掉該藥品。
孕婦及哺乳期婦女用藥
妊娠
培門冬酶沒有進行動物生殖毒性研究。目前不知培門冬酶在孕婦是否會導致胎兒傷害,以及是否影響生殖能力。培門冬酶應該在明確必須給藥的情況套用於妊娠婦女。
哺乳
培門冬酶是否分泌於人類的乳汁中不得而知。因為許多藥物會分泌到乳汁中,並且培門冬酶對哺乳幼兒有潛在的危害,要根據藥物對母親的重要性來權衡是否對哺乳母親使用藥物治療。
兒童用藥
支持本品註冊的臨床試驗主要在18歲以下患者中進行,具體見【臨床試驗】和【不良反應】項。
老年用藥
培門冬酶沒有進行65歲或更大年齡患者的臨床研究,尚不明確老年患者的反應是否與兒童或年青患者存在差異。
藥物過量
國外文獻報導,三名患者靜脈注射Oncaspar®10,000 IU/m2。1位患者出現輕度肝酶增加。1位患者在開始注射10分鐘後出現皮疹,通過使用抗組胺藥物和減慢輸注速度得到控制。另1位患者未出現任何副反應。
臨床試驗
◇國外臨床研究
急性淋巴細胞白血病的一線治療臨床研究
在一項開放、多中心、隨機、陽性藥對照的試驗中評價了Oncaspar®的安全性和有效性。該試驗中入組了118位先前未曾治療過的1~9歲的標危的急性淋巴細胞白血病患者,隨機分為Oncaspar®組和大腸桿菌左旋門冬醯胺酶組(聯合治療方案的組分之一)進行治療。Oncaspar®的劑量為2500 IU/m,於為期4周的誘導期第3天以及兩個為期8周的強化治療期第3天進行肌肉注射。天然大腸桿菌左旋門冬醯胺酶給藥劑量為6000IU/m,在誘導期每周給藥3次,連續3周;在兩個延遲強化治療期分別給藥6次。
主要療效指標是檢測Oncaspar®組和大腸桿菌左旋門冬醯胺酶組患者血清門冬醯胺濃度水平(減少的程度和時間長短)。達到指定門冬醯胺的目標濃度是 ≤ 1 μM。兩個臨床研究組患者在三個治療階段達到這個目標濃度的比例是一樣的。
在兩個組別各個不同的治療階段,血清門冬醯胺濃度都是在門冬醯胺酶給藥後4日內下降,並且在隨後3周門冬醯胺仍保持低濃度。藥物治療誘導期血清中門冬醯胺的濃度見圖1。在強化治療期門冬醯胺耗竭的模式和誘導期藥物耗竭的模式是相似的。
 培門冬酶注射液
培門冬酶注射液注意:培門冬酶的劑量為2500 IU/m,於為期4周的誘導期第3天進行肌肉注射。天然大腸桿菌左旋門冬醯胺酶給藥劑量為6000 IU/m2,在誘導期每周給藥3次,連續3周共9次。
對50例誘導期患者腦脊液中門冬醯胺濃度進行了檢測。腦脊液中門冬醯胺從給藥前3.1 μM 下降到Oncaspar®給藥後第4 ± 1天的1.7 μM,第21 ± 1天的1.5 μM。這些情況和天然大腸桿菌左旋門冬醯胺酶給藥後是類似的。兩個給藥組3年無事件生存期約為80%,結果類似。該研究方案中事先沒有設計評價無事件生存期的差別。
對門冬醯胺酶高敏的患者臨床研究
在4項開放的研究中,包括了42名對左旋門冬醯胺酶產生臨床過敏、多次復發的急性白血病患者(39%為急性淋巴細胞白血病),對Oncaspar®的安全性和有效性進行了評價。對左旋門冬醯胺酶高敏的定義為天然大腸桿菌左旋門冬醯胺酶給藥後產生全身性皮疹、風疹、支氣管痙攣、喉水腫、低血壓、局部紅斑或腫脹,大於2 公分,持續至少10分鐘。所有接受Oncaspar®治療的患者進行肌肉或靜脈注射,劑量為2000,2500 IU/m,每14天給藥1次。Oncaspar®作為單藥治療或者聯合治療的一個組份。再次誘導治療的總反應率為50%(95%的可信區間為35%~65%),36%完全緩解,14%部分緩解。這個結果與急性淋巴細胞白血病患者接受含大腸桿菌左旋門冬醯胺酶的聯合二線化療的總反應率是類似的。Oncaspar®單藥治療也觀察到抗腫瘤活性。在9個復發的或對天然大腸桿菌左旋門冬醯胺酶高敏的成人和兒童急性淋巴性白血病患者中,有3個患者產生反應(1個完全緩解,2個部分緩解)。
◇國內臨床研究
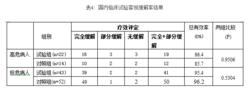
在中國兒童患者中進行了一項多中心、單盲、隨機、陽性對照的臨床研究。共入組131例初治的標危及高危的兒童急性淋巴細胞白血病患者,男性84例,女性47例,年齡3~18歲,隨機分為培門冬酶聯合化療試驗組(簡稱試驗組)和天然的左旋門冬醯胺酶聯合化療對照組(簡稱對照組)。試驗組65例,對照組66例, 依據《血液學診斷及療效標準》(第二版 張之南)進行診斷和療效判定。培門冬酶的劑量為2500 IU/m,第10, 24天肌肉注射給藥, 左旋門冬醯胺酶的劑量為6000 IU/m2,第10,12,14,16,18,20天靜脈滴注給藥; 均聯合長春新鹼、潑尼松、及柔紅黴素(柔紅黴素, 靜脈滴注,30 mg/ m2/次,第8、9天給藥, 標危組共2次,高危組共4次;長春新鹼, 最大2 mg 靜脈滴注,2 mg/ m/次,第8、15、22、29天給藥共4次;潑尼松, 口服,40 mg/ m,最大60 mg/d,第1~35天給藥,共4周)。結果試驗組與對照組間緩解率比較,差異無統計學意(見表4)。
 培門冬酶注射液
培門冬酶注射液藥理毒理
藥理作用
培門冬酶通過選擇性耗竭血漿中的門冬醯胺而殺傷白血病細胞。這些白血病細胞由於缺乏門冬醯胺合成酶不能合成門冬醯胺,而需依賴外來的門冬醯胺存活。通過門冬醯胺酶來耗竭血液中的門冬醯胺,可以殺死白血病細胞。然而正常細胞由於含有門冬醯胺合成酶,不缺乏門冬醯胺,較少受藥物的影響。
毒理研究
·培門冬酶尚未進行動物長期致癌性試驗。
·培門冬酶尚未進行致突變的研究。在沙門氏菌Ames試驗中,沒有觀察到藥物的致突變作用。
·培門冬酶尚未進行生殖毒性試驗。
藥代動力學
◇國外藥代動力學研究
藥代動力學的評估是基於門冬醯胺酶的酶活性檢測進行的。在研究1中(見【不良反應】項) 34例新診斷的標危兒童患者研究了肌肉注射Oncaspar®2500 IU/m2的藥代動力學。消除半衰期在誘導期患者為5.8天。在延遲強化階段1和延遲強化階段2中得到的消除半衰期與上述結果相似。在誘導期、延遲強化階段1和延遲強化階段2患者檢測發現,連續20天,在多於90%的試驗病人樣品中,藥物濃度大於0.1 IU/ml。
在3項藥代動力學研究中,37例急性淋巴細胞白血病復發患者每兩周肌肉注射一次2500 IU/m。結果顯示在9例對大腸桿菌左旋門冬醯胺酶高敏的患者血漿半衰期為3.2±1.8天,在28例對大腸桿菌左旋門冬醯胺酶非高敏的患者血漿半衰期為5.7±3.2天。在9例對大腸桿菌左旋門冬醯胺酶高敏的患者AUC為9.5±4.0 IU/ml/天,在對大腸桿菌左旋門冬醯胺酶非高敏的患者血漿AUC為9.8±5.9 IU/ml/天。
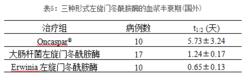
在對新診斷的兒童急性淋巴細胞白血病的研究中,給病人肌肉注射Oncaspar® (2500 IU/m),大腸桿菌左旋門冬醯胺酶(25000 IU/m),或Erwinia 左旋門冬醯胺酶(25000 IU/m),三種形式的左旋門冬醯胺酶的血漿半衰期分別如下表5:
 培門冬酶注射液
培門冬酶注射液◇國內藥代動力學研究
使用免疫測試法(BA-EIA),在11例中國急性淋巴細胞白血病兒童患者(男7人,女4人)中進行了培門冬酶藥代動力學研究。在肌肉注射2500 IU/m培門冬酶注射液(每2周給藥一次,共給藥2次)後的血清樣品中,定量檢測培門冬酶濃度,得到血清藥物濃度-時間曲線,獲得相關的藥代動力學參數如下表6:
 培門冬酶注射液
培門冬酶注射液貯藏
遮光、密閉,在2~8℃處保存,避免冷凍結冰。
