鈰量法
正文
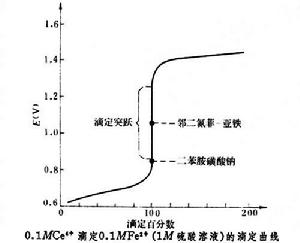
採用四價鈰鹽溶液作滴定劑的容量分析方法。1861年由 L.T.蘭格建立。在酸性溶液中,Ce4+與還原劑作用,被還原為Ce3+,E°(Ce4+/Ce3+)=1.61伏。在1~8Μ高氯酸溶液中,E=+1.70~+1.87伏;在 1~8Μ硝酸溶液中,E=-1.44~-1.42伏;在鹽酸溶液中,Ce4+不很穩定,會緩慢地將Cl-氧化為Cl2,隨著酸度的增高,氧化速率也增高,但在硫酸存在下,氧化速率會減低。所以,實際上常用硫酸鈰的硫酸溶液作滴定劑,它非常穩定。而在硝酸或高氯酸溶液中,在光的作用下,Ce4+會緩慢地被水還原,使其濃度逐漸下降。Ce4+易水解而生成鹼式鹽沉澱,因此不適合在弱酸性或鹼性溶液中滴定。在鈰量法中,雖然Ce4+具有黃色,Ce3+為無色,但由於Ce4+的黃色不夠深,不能作為指示滴定終點的自身指示劑,要選用適當的氧化還原指示劑,如鄰二氮菲-亞鐵指示劑。鈰量法的滴定曲線見圖。
 鈰量法
鈰量法