化學遷移反應
正文
凝聚態物質與氣體結合生成氣態化合物,遷移到另一溫度與壓力的環境,又自行分解,達到物質的提純或改變物理狀態(或二者兼有)的反應。例如,凝聚相物質M(單質或化合物)與氣體A(單質或化合物)在一定溫度t1及壓力p1下結合生成氣態化合物MxAy: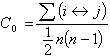 (1)
(1)
碘化法
碘化法提純鋯是化學遷移反應在冶金中套用的一個例子:
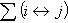 (2)
(2)
 化學遷移反應
化學遷移反應 化學遷移反應
化學遷移反應羰基法
用羰基法製備不同形態的高純鎳,是冶金中套用化學遷移反應原理的又一例:
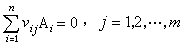 (3)
(3)
歧化反應
用鋁的一價氯化物的歧化反應(dispro-portion reaction)從鋁或鋁合金(如鋁鐵或鋁矽合金)中提取純鋁:
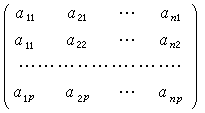 (4)
(4)
化學遷移反應的熱力學條件
化學遷移反應是一個可逆反應,它必要的熱力學條件是:①生成氣相中間產物的反應自由焓表達式ΔG=A+BT中A與B的符號必須相反。②反應向逆方向進行的轉化溫度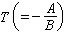 必須是一個便於操作的溫度。如果溫度太高,則可採用真空以降低此溫度。高壓操作可提高反應速度,改善動力學條件。被遷移物質Μ的遷移方向取決於生成氣相中間產物反應的焓變ΔH(即A)的符號(表2)。
必須是一個便於操作的溫度。如果溫度太高,則可採用真空以降低此溫度。高壓操作可提高反應速度,改善動力學條件。被遷移物質Μ的遷移方向取決於生成氣相中間產物反應的焓變ΔH(即A)的符號(表2)。
 化學遷移反應
化學遷移反應H. Schfer, Chemical Transport Reactions,Academic Press, New York,1964.
魏壽昆:《冶金過程熱力學》,第五章,上海科學技術出版社,上海,1980。