介紹
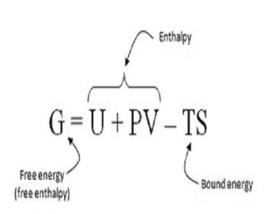
在熱力學裡,自由焓,又稱吉布斯自由能、吉布斯函式、吉布斯能,常用英文字母“”標記。吉布斯能是國際化學聯會建議採用的名稱。吉布斯能是描述系統的熱力性質的一種熱力勢。
假設在等溫等壓狀況下,一個熱力系統從良好定義初態變換到良好定義終態,則其吉布斯能減少量必定大於或等於其所做的非體積功;假若這變換是可逆過程,則其吉布斯能減少量等於其所做的非體積功。所以,這熱力系統所能做的最大非體積功是其吉布斯減少量。
在等溫等壓狀況下,一個熱力過程具有自發性的必需條件為,吉布斯能隨著過程的演化而減小。這意味著,平衡系統的吉布斯能是最小值;在平衡點,吉布斯能對於其它自變數的導數為零。
吉布斯能可以用來評估一個反應是否具有自發性,它可以用來估算一個熱力系統可以做出多少非體積功。當套用熱力學於化學領域時,吉布斯能是最常用到與最有用的物理量之一。吉布斯能是為紀念美國物理學者約西亞·吉布斯而命名。
早期,化學家使用術語“親和勢”來描述促成化學反應的因素,但這術語已過時,現今已被術語“自由能”替代,自由能是一種比較先進與準確的術語。
1873年,吉布斯發表論文《用曲面方法來幾何表現出物質的熱力學性質》。在這篇論文裡,他詳細論述他的新方程的原理。這方程可以預測或估算,當幾樣物體或系統接觸在一起之時,各種自然過程發生的趨勢。通過研究幾樣均一性物質接觸時的相互作用,例如,由一部分固體、一部分液體與一部分氣體構成的物體,又通過展示相關體積-熵-內能三維圖,吉布斯可以判斷三種平衡狀態,即穩定平衡、中性平衡或不穩定平衡,以及是否會發生後續變化。
 約西亞·吉布斯
約西亞·吉布斯計算公式
自由焓計算公式(吉布斯亥姆霍茲方程):ΔG=ΔH-TΔS
若反應為吸熱反應ΔH〉0,熵變小於零的話,任意溫度下,ΔG〉0反應逆向自發進行
若反應為放熱反應ΔH〈0,熵變大於零的話,任意溫度下,ΔG〈0反應正向自發進行
若反應為吸熱反應ΔH〉0,熵變大於零的話,高溫條件下,ΔG〈0反應正向自發進行
若反應為放熱反應ΔH〈0,熵變小於零的話,低溫條件下,ΔG〈0反應正向自發進行
自由焓變數
在等溫等壓下一個過程或反應能否自發地進行,取決於自由焓變數ΔG是負值還是正值。ΔG為負值的反應可以進行;負值越大,則該反應進行的趨勢越大。兩個同類型反應,其進行的先後順序取決於其ΔG負值的大小,負值大的反應優先進行。當ΔG=0,該反應達到平衡,也即反應向正方向進行的速度與向反方向進行的速度相等。
溶解自由焓
某元素溶於金屬液成為冶金熔體,其溶液生成自由焓稱為溶解自由焓。由於活度有不同標準狀態,因之標準溶解自由焓根據標準態的不同而有不同值。
可以證明:①對純物質標準態,ΔG°=0。高濃度合金熔體,熔渣(以氧化物為組分)等通常採用純物質標準態。②對重量1%濃度溶液的標準態,其標準溶解自由焓用ΔG表示。
化學反應
化學反應也是一種熱力學過程,所以前面的分析也適用於化學反應。在等溫等壓狀況下,吉布斯能減少量可以用來評估化學反應的自發性,而當吉布斯能變化量等於零時,化學反應處於平衡狀態。
標準生成
由於熱力學不能定義自由焓的絕對數值,所以實際套用時,可以利用它是狀態函式的性質來計算物質的標準生成自由焓,全名為“標準摩爾生成自由焓”。首先,需要設定參考狀態的標準生成自由能為零;在標準狀況下,所有最穩定形式的元素都被指定為處於參考狀態。下一步,對於化合物或其它形式的元素,它們的標準生成自由焓被設定為,從最穩定形式的元素生成一摩爾化合物或其它形式的元素,所需要的自由焓變化量。在實驗方面,有很多方法可以用來估算物質的標準生成自由焓,例如,可以從物質的焓變化量與熵變化量實驗數據,利用自由焓的定義式估算出來。平常運算則可以從焓與熵列表里查詢相關數值。
假若某物質的標準生成自由焓是負值,則稱該物質為“熱力學穩定物質”;假若是正值,則為“熱力學不穩定物質”。例如,水的標準生成自由焓是負值,所以在標準狀況下很穩定。又例如,苯的標準生成自由焓是正值,所以在標準狀況下不穩定。
套用
冶金反應經常是有多相參加的反應。改變自由焓是控制冶金反應方向及平衡態的手段。通過改變四個因素,即溫度、活度、壓力及添加劑可以變更反應自由焓,由正變負,由大變小,從而可選擇地使某些反應優先進行,某些反應推遲進行,或創造條件使不能進行的反應可以進行,以達到預期結果。當反應達到平衡時,利用平衡常數可以調整產物的組成。
由等溫方程式可理解,改變反應進行時的溫度、壓力或參加物質的活度(或三種因素同時改變),可改變反應自由焓。添加劑的作用可用碳作為添加劑對高鈦渣(或金紅石)氯化時自由焓的變化加以說明。
利用化合物生成自由焓數據繪製的Ellingham-Ric-hardson圖,直接示出同類化合物穩定性大小的相對次序,給出氧化-還原的轉化溫度,為研究和分析同類型化學反應的相互關係提供依據。溶於鐵液內各元素以O直接氧化的ΔG°對T的關係見圖,用以研究分析:①煉鋼過程中雜質元素氧化的先後順序;②進行元素選擇性氧化的可能性和條件;③元素脫氧能力強弱的比較;④電弧爐煉鋼時合金元素加入的先後順序等等。其他如焙燒、氯化等過程都可運用類似的生成自由焓對溫度的關係圖進行綜合分析。Ellingham-Richardson圖一般用標準生成自由焓ΔG°繪出,但對實際生產問題則必須利用等溫方程式具體計算出的自由焓ΔG進行分析。