熔鹽電解
正文
利用電能加熱並轉換為化學能,將某些金屬的鹽類熔融並作為電解質進行電解,以提取和提純金屬的冶金過程。熔鹽電解在19世紀初已開始套用,隨著熔鹽電化學的迅速發展,至19世紀末期就以工業規模生產鋁、鎂等輕金屬。以後,又用於稀有金屬的生產。熔鹽電解質 熔鹽是熔融狀態的鹽類,其中主要是鹵化物。熔鹽是離子熔體,有較高的電導率;在比熔點稍高的溫度時,晶體結構雖然由於熱運動而鬆散、潰亂,但在一定的距離內仍保持一定的有序性,稱為近程式結構。
在電解中使用的熔鹽電解質應該具有較低的熔點,適當的粘度、密度、表面張力,足夠高的電導率,以及相當低的揮發性和不溶解被電解出來的金屬熔體等性質。為了達到這些要求,常常使用由幾種鹽類組成的混合物。它們常具有比純組分更低的熔點,但也有不少例外。所以,必須通過實驗來選擇適當的混合鹽組成。通常,電解鎂用NaCl-KCl-MgCl2混合熔鹽;電解鋁用Na3AlF6-Al2O3混合熔鹽。電解鉭則用K2TaF7-Ta2O5混合熔鹽;電解鈹用BeF2·NaF-BaF2或NaCl-BeCl2混合熔鹽。
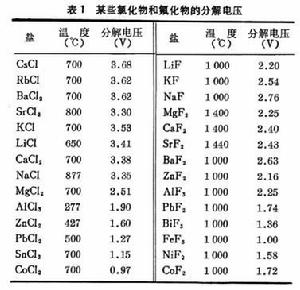
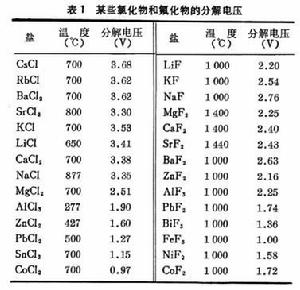
影響熔鹽電解的因素 和水溶液電解質一樣,當熔融電解質與金屬接觸時,兩者之間將產生一定的電勢差,即電極電勢。在同一熔鹽中插入兩個電極,並利用外加電壓通過直流電,當電壓達到一定的數值時,熔鹽中的某些組分將分解,平衡狀態下化合物開始分解的電壓稱為分解電壓(表1)。常見金屬的電化當量見表2。熔鹽的性質和它的組成、金屬離子和陰離子的性質都會影響電化順序中各金屬的相對位置。
 熔鹽電解
熔鹽電解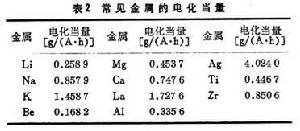 熔鹽電解
熔鹽電解CaCl2+Ca─→2CaCl
AlCl3+2Al─→3AlCl
低價化合物重溶於熔鹽中,並易被空氣或陽極析出的氣體氧化而成為高價化合物,因而引起更多的金屬被溶解,降低電流效率。此外,析出的金屬也可從熔鹽中置換出其他金屬,而溶解於熔鹽中。
陰極反應 熔鹽電解時陰極上進行的反應為:
Men++ne─→Me
式中Me為金屬,n為得失電子數。當熔鹽溫度高於金屬的熔點時,所得金屬為液態。在工業生產中,有時液態金屬即成為陰極表面,如電解鋁;由於工藝要求及電解槽構造的不同,有時生成的液態金屬迅速自金屬陰極離開,如電解鎂、鋰、鈉等。若熔鹽溫度低於金屬熔點時,所得金屬為固態。隨著條件的不同,可以得到金屬粉末、片狀晶體或薄層覆蓋物。由於高熔點金屬的廣泛套用,熔鹽電解法在這些金屬的製備中也獲得更大的進展。如鈹、鋯、鉭、鈮、釷等都可用此法製備。
陽極反應 在電沉積時常使用碳電極作為陽極,而在電解精煉時則使用粗金屬電極。使用碳電極時,如MgCl2的電解,陽極反應可以使氯離子放電而析出氯氣:
2Cl-─→Cl2↑+2e
也可以是碳與氧的化合,如Al2O3在冰晶石熔體中的電解,生成CO或CO2:
2O2-+C─→CO2↑+4e
在電解精煉中,粗金屬作為陽極,其反應為:
Me─→Men++ne
電極電勢較被提取金屬為正的雜質將不溶解,而電極電勢較被提取金屬為負的雜質,雖溶解於熔鹽內,但不能在陰極析出,從而起到提純的作用。