載脂蛋白CⅡ
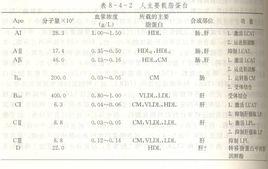
載脂蛋白C(Apo CⅡ)是CM、VLDL和HDL的結構蛋白之一,分別占其蛋白成份的14%、7%~10%及1%~3%。Apo CⅡ在血漿中的濃度為0.03-0.05g/L。
結構
人Apo CⅡ為含79個胺基酸殘基的單鏈多肽,分子量為9.1kD。先合成的Apo CⅡ含101胺基酸殘,其中 22個胺基酸構成信號肽,除去信號肽後則轉變為成熟Apo CⅡ。Apo CⅡ的等電點為5.0,其胺基酸組成有3個特點: ⑴缺乏組氨酸和半胱氨酸; ⑵ 含有較多的極性胺基酸; ⑶蘇氨酸及絲氨酸較高。
對Apo CⅡ的胺基酸序列進行Chuo-Fasman分析表明: Apo CⅡ的第13-22,29-40,43-52胺基酸殘基為雙性α螺旋,具有與脂質結合的功能,第9-12、23- 26 、53-56胺基酸殘基為β轉角結構,第61-74AA殘基為α-雙性螺旋,是與脂質 結合的區域,第1-39、54-69胺基酸殘基為β-轉角結構。對Apo CⅡ溴化氰水解片段或合成片段的研究表明: Apo CⅡ激活LPL的肽段為羧基端56-79胺基酸殘基,其激活作用可被具有結合磷脂活性的第44-55胺基酸殘基段加強; 切除Apo CⅡ羧基末端3 個胺基酸殘基,Apo CⅡ激活LPL的活性完全喪失。
Apo CⅡ基因與Apo CI、Apo E基因成簇排列,位於19 號染色體長臂 q13 區。Apo CⅡ基因長3320bp,含4個外顯子和3個內含子。外顯子分別為29bp 、 68bp 、160bp和241bp。外顯子1包括mRNA 5'端非翻譯區的大部分,外顯子2包含5' 端非翻譯區的小部分(約13bp)及信號肽中前18 個胺基酸的密碼子,外顯子3由編碼信號肽後9個胺基酸及成熟Apo CⅡ蛋白的1050位胺基酸的核苷酸組成。外顯子4 包括編碼成熟Apo CⅡ蛋白的51-79位胺基酸的核苷酸順序及3'端非編碼區。在3'非編碼區有3個poly A信號,在此apoly A後還有一個Alu復序列存在,其意義尚不清楚。內含子分別為2386bp、1676和296bp。內含子1位於蛋氨酸起始密碼(翻譯起始點)上游第13與14核苷酸之間,把外顯子1和外顯子2隔開。內含子2在編碼信號肽的第4位胺基酸的密碼子處把外顯子2和外顯子3隔開。內含子3則在編碼第50 胺基酸密碼子處將外顯子3和外顯子4隔開。內含子1含有4個Alu重複序列且富含GC。內含子3含有 36- 40bp 的重複序列,在這些重複序上游 31bp處有一個潛在的增強核心序列: CATACCAC。在轉錄起始點上游6個bp組成TATA盒,可能為啟動子的一部分。
生理功能
(一)、LPL是CM和VLDL水解的關鍵酶。研究表明: Apo CⅡ是LPL不可缺少的激活劑,Apo CⅡ缺乏時,LPL 活性極低; apo CⅡ存在時,LPL活性可增加10-50倍,因此apo CⅡ具有促進CM和VLDL降解的作用。apo CⅡ激活LPL的機理可能是: Apo CⅡ從"酶-底物"中間體接受脂醯基,然後將其轉移到白蛋白上。
(二)、Apo CⅡ還具有抑制肝臟對CM和VLDL攝取的作用。
(三)、在體外試驗中發現,Apo CⅡ還可抑制HTGL活性,抑制程度與Apo CⅡ濃度呈線性關係。由於HL可催化經LPL作用後脂蛋白殘粒中TG水解,因此Apo CⅡ亦可能參與血漿中脂蛋白殘粒的清除過程。
(四)、Apo CⅡ也能激活LCAT,但其作用遠弱於Apo AI和Apo CI等。
多態性
有關Apo CⅡ的多態性報導尚不多見。
突變
Apo CⅡ基因有多種變異: ⑴ Apo CⅡ缺乏症: 自1978年Breckenridge等首次報導第一例高甘油三酯血症患者為Apo CⅡ缺乏症以來,已在日本、英國、 義大利和美國等地發現了數十例這種病人。Apo CⅡ缺乏為常染色體隱性遺傳病。雜合子血漿Apo CⅡ水平僅為正常的一半,血漿甘油三酯濃度尚能維持正常,純合子則漿Apo CⅡ完全缺乏,雖然LPL結構正常,血漿Apo CⅡ仍高達10g/L以上,表現為I型高脂蛋白血症,嚴重時可引起肝脾腫大,誘發急性胰腺炎。⑵ Apo CⅡ 基因突變使Apo CⅡ功能喪失。Connelly等報導了一例變異Apo CⅡ,即Apo CⅡ Toronto。其Apo CⅡ的第1-68 AA正常,而69-74 AA被4個大鹼基插入於Apo CⅡ基因,使翻譯閱讀移碼,提前出現終止密碼所致。Apo CⅡToronoto無激活LPL的功能。⑶ Apo CⅡBethesda Dennis等1988年發現: 一患者血漿甘油三酯水平極高,Apo CⅡ 含量低於0.005g/L,Apo E含量偏高。進一步研究發現,患者Apo CⅡ免疫活性正常,但分子量小,等電點較正常升高,作者稱這種變異的Apo CⅡ為Apo CⅡBethesda。家系分析發現:先證者母親的血漿同時含有正常Apo CⅡ與Apo CⅡBethesda; 而其父親血漿Apo CⅡ完全正常。推測患者系其母親Apo CⅡBethesda基因與其父親Apo CⅡ的反常等位基因或完全缺失的等位基因所形成的雜合子。⑷Apo CⅡ的另一變異系第55位賴氨酸殘基為谷氨酸所取代。這種突變不影響Apo CⅡ激活LPL的功能。此突變的等位基因在黑人中發生頻率甚高,為12%。