定律表述
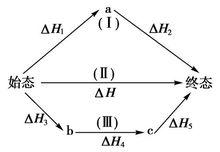
赫斯定律定義:一個反應,在定壓或定容條件下,不論是一步完成還是分幾步完成,其反應熱是相同的,總反應方程式的焓變等於各部分分布反應按一定係數比加和的焓變。赫斯定律換句話說,化學反應的反應熱只與反應體系的始態和終態有關,而與反應的途徑無關,而這可以看出,赫斯定律實際上是“內能和焓是狀態函式”這一結論的進一步體現。
推導過程
 赫斯定律
赫斯定律當反應體系不做非體積功,Q=ΔH,Q=ΔU,而H和U都是狀態函式,當反應的初始狀態和終止狀態一定時,H和U的改變值ΔH和ΔU與途徑無關。所以無論是一步完成反應,或是多步完成反應,反應是否有中間步驟或有無催化劑介入等,均對Q或Q數值沒有影響,其反應熱都一樣。
適用範圍
適用於任何狀態函式,但使用該定律要注意:
1、赫斯定律只適用於等溫等壓或等溫等容過程,各步反應的溫度應相同;
2、參與反應的各物質的本性、聚集狀態、完成反應的物質數量,反應進行的條件方式、溫度、壓力等因素均一致。
3、各步反應均不做非體積功。
4、若有很多數據,選擇最短的途徑。以致計算方便誤差小。
實際套用
有些反應的反應熱通過實驗測定有困難(有些反應進行得很慢,有些反應不容易直接發生,有些反應的產品不純、有副反應發生),可以用赫斯定律間接計算出來。
 赫斯定律
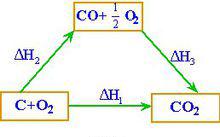
赫斯定律例 求反應C(s)+ 1/2 O (g)→CO(g)的反應熱ΔH解:已知 (I) C(s)+ O (g)==CO(g) ΔH = - 393.5 kJ/moI
(II)CO(g)+ 1/2 O (g)==CO (g) ΔH = - 282.0 kJ/mol
由(I)-(II)式得 C(s)+ 1/2 O (g)== CO(g)
ΔH = ΔH(I)- ΔH (II)
= - 393.5 -( - 282.0)= -110.5 kJ/mol
C和O的反應不可能控制在CO而無CO生成的程度,因此無法通過實驗測定這樣反應的反應熱。然而根據赫斯定律,利用C和CO的燃燒熱,很容易計算生成CO反應的焓變。
定律影響
儘管赫斯定律出現在熱力學第一定律提出前的經驗定律,但亦可通過熱力學第一定律推導出。赫斯定律的建立,使得熱化學反應方程式可以向普通代數方程式一樣進行計算,有很大的實用性。