科學解釋
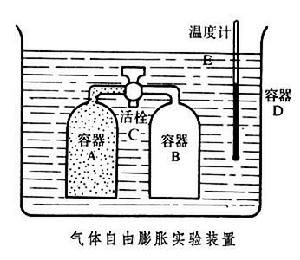
 自由膨脹
自由膨脹實驗結論
焦耳實驗(Joule’s experiment)得出以下結論,在自由膨脹中,氣體的內能不變;或者說,氣體的內能與體積無關,只與溫度有關。後來精確的實驗證明,焦耳的結論只對理想氣體才是正確的。
過程
由於體系經歷絕熱過程,故與外界無熱交換。又由於氣體向真空自由膨脹,外壓為零,故體系對環境做功也為零。由熱力學第一定律可得體系內能的變化為零,理想氣體的內能只是溫度的函式,所以理想氣體絕熱自由膨脹後溫度將恢復原來的溫度。
說明:
(1)雖然理想氣體絕熱自由膨脹後溫度恢復,但整個過程並不是恆溫過程。
(2)理想氣體絕熱自由膨脹過程是非準靜態過程,除初,末態外,系統每一時刻都處於非平衡態。
(3)對於實際氣體,溫度一般不會恢復到原來溫度。
實驗證實參見焦耳實驗:容器分為兩室,左邊貯有理想氣體,右邊為真空.如果將隔板抽開,左室中的氣體將向B室膨脹。這是氣體對真空的自由膨脹,最後氣體將均勻分布於兩室。溫度與原來溫度相同。氣體膨脹後,我們仍可用活塞將氣體等溫壓回左室,使氣體回到初始狀態。不過,此時我們必須對氣體作功,所作的功轉化為氣體向外界傳出的熱量,根據熱力學第二定律,我們無法通過循環過程再將這熱量完全轉化為功,所以氣體對真空的自由膨脹過程是不可逆過程。