概述
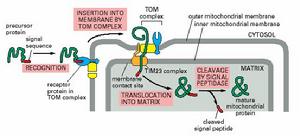 線粒體蛋白質的定向轉運
線粒體蛋白質的定向轉運線粒體的蛋白合成能力有限,大量線粒體蛋白在細胞質中合成,定向轉運到線粒體。這些蛋白質在在運輸以前,以未摺疊的前體形式存在,與之結合的分子伴侶(屬hsp70家族)保持前體蛋白質處於非摺疊狀態。通常前體蛋白N端有一段信號序列稱為導肽、前導肽或轉運肽(leadersequence、presequence或transit-peptide),完成轉運後被信號肽酶(signalpeptidase)切除,就成為成熟蛋白,這種現象就叫做後轉譯。
線粒體前體蛋白信號序列的特點是:①多位於肽鏈的N端,由大約20個胺基酸構成;②沒有帶負電荷的胺基酸,形成一個兩性α螺鏇,帶正電荷的胺基酸殘基和不帶電荷的疏水胺基酸殘基分別位於螺鏇的兩側,現在認為這個螺鏇與轉位因子的識別有關;③對所牽引的蛋白質沒有特異性要求,非線粒體蛋白連線上此類信號序列,也會被轉運到線粒體。此外有些信號序列位於蛋白質內部,完成轉運後不被切除,還有些信號序列位於前體蛋白C端,如線粒體的DNA解鏇酶Hmil。
轉位因子
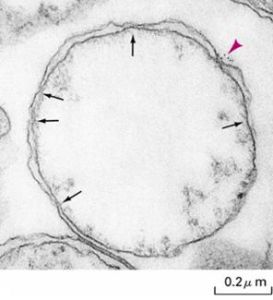 線粒體內外膜的接觸點
線粒體內外膜的接觸點蛋白質的轉運涉及多種蛋白複合體,即轉位因子(translocator),由兩部分構成的:受體和蛋白質通過的孔道。主要包括:①TOM複合體,負責通過外膜,進入膜間隙,在酵母中TOM70負責轉運內部具有信號序列的蛋白,TOM20負責轉運N端具有信號序列的蛋白,這兩種蛋白的功能都相當於內質網上的SPR受體,在人類線粒體中hTom34的功能與TOM70相當。
TOM複合體的通道被稱為GIP(generalimportpore),就相當於內質網上的SEC61複合體,主要由Tom40構成,還包括Tom22,Tom7,Tom6和Tom5;②TIM複合體,其中TIM23負責將蛋白質轉運到基質,也可將某些蛋白質安插在內膜;TIM22負責將線粒體的代謝物運輸蛋白,如ADP/ATP和磷酸的轉運蛋白插入內膜;③OXA複合體:負責將線粒體自身合成的蛋白質插到內膜上,同樣也可使經由TOM/TIM複合體進入基質的蛋白質插入內膜。
運輸過程
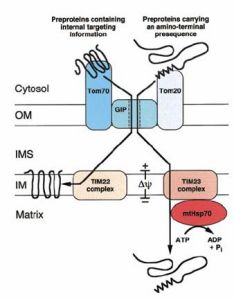 線粒體的蛋白轉運裝置
線粒體的蛋白轉運裝置線粒體具有四個功能區隔,即外膜、內膜、膜間隙、基質。進入不同部位的蛋白具有不同的轉運途徑。
進入外膜的蛋白具有不被切除的N端信號序列,其後還有疏水性序列作為停止轉移序列,然後蛋白質被TOM複合體安裝到外膜上,如線粒體的各類孔蛋白。
進入基質蛋白質可以先通過TOM複合體進入膜間隙,然後通過TIM複合體進入基質。也可以通過線粒體內、外膜間的接觸點(鼠肝直徑1um線粒體上約115個接觸點),一步進入基質,在接觸點上TOM與TIM協同作用完成蛋白質向基質的輸入。
進入線粒體內膜和膜間隙的蛋白具有以下幾種情況(圖7-30):①蛋白N端具有兩個信序列,首先被運送到基質,然後N端信號肽被切除,暴露出導向內膜的信號序列,在OXA的幫助下插入內膜。如果第二段信號序列被內膜外表面的異二聚體內膜蛋白酶(heterodimericinnermembranepeptidase,Imp1/imp2)切除,則成為膜間隙蛋白。②N端信號序列的後面有一段疏水序列,扮演停止轉移序列的角色,能與TIM23複合體結合,當進入基質的信號序列被切除後,脫離轉位因子複合體而進入內膜,如果插入膜中的部分又被酶切除,側成為定位於膜間隙的蛋白。③線粒體內膜上負責代謝底物/產物轉運的蛋白,如腺苷轉位酶是多次跨膜蛋白,其N端沒有可被切除的信號序列,但包含3-6個內部信號序列,可被TIM22複合體插到內膜上。蛋白質的輸入是一個耗能的過程,能量的來源為水解ATP和利用質子動力勢.能量消耗線上粒體外和進入線粒體基質兩步上,線上粒體外解除與前體蛋白質結合的分子伴娘,需要通過水解ATP獲得能量;在通過TIM複合體進入基質時利用質子動力勢作為動力。雖然目前含不清楚質子動力勢是如何被利用的,但解偶連線如DNP能抑制蛋白質的轉運。前體蛋白進入線粒體基質後,線粒體hsp70一個接一個的結合在蛋白質線性分子上,像齒輪一樣將蛋白質“鉸進(handoverhand)”基質,這一過程也需要消耗ATP。然後線粒體hsp70將蛋白質交給hsp60,完成摺疊。
