科技名詞定義
中文名稱:信號肽
英文名稱:signal peptide
其他名稱:信號序列(signal sequence)
定義1:分泌蛋白前體N-末端的15~30個胺基酸,在多肽鏈合成中有其特定的作用。
套用學科:昆蟲學(一級學科);昆蟲生理與生化(二級學科)
定義2:分泌蛋白新生肽鏈N端的一段20~30胺基酸殘基組成的肽段。將分泌蛋白引導進入內質網,同時這個肽段被切除。現這一概念已擴大到決定新生肽鏈在細胞中的定位或決定某些胺基酸殘基修飾的一些肽段。
套用學科:生物化學與分子生物學(一級學科);胺基酸、多肽與蛋白質(二級學科)
結構
 信號肽
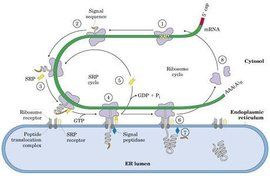
信號肽信號肽位於分泌蛋白的N端。一般由15~30個胺基酸組成。包括三個區:一個帶正電
的N末端,稱為鹼性氨基末端:一個中間疏水序列.以中性胺基酸為主,能夠形成一段d螺鏇結構,它是信號肽的主要功能區;一個較長的帶負電荷的C末端,含小分子胺基酸,是信號序列切割位點.也稱加工區。當信號肽序列合成後,被信號識別顆粒(SRP)所識別,蛋白質合成暫停或減緩,信號識別顆粒將核糖體攜帶至內質網上,蛋白質合成重新開始。在信號肽的引導下,新合成的蛋白質進入內質網腔.而信號肽序列則在信號肽酶的作用下被切除[21。如終止轉運序列存在於新生肽鏈的C端.也可以不被信號肽酶切除.如卵清蛋白含有內部信號肽。它的前體與成熟形式都沒有被信號肽酶切除的過程.其N一端胺基酸結構在第9位有帶電基團,疏水結構並不明顯。
功能
輸送
 信號肽
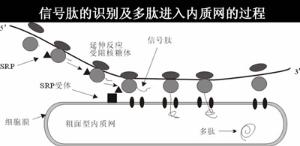
信號肽信號肽可使正在翻譯的核糖體附著到RER膜上。
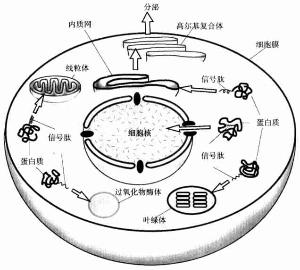
在信號肽指引下蛋白質在細胞內的輸運
核糖體是通過信號肽的功能而附著併合成分泌蛋白的。因此游離的核糖體和膜結合核糖體之間本身並無差異。信號肽是作為一種附著到ER膜上的信號識別,此可能通過開始合成出的N-端頭幾個胺基酸的疏水功能。然後蛋白鏈插進膜中,信號肽埋在膜中的一種蛋白酶所剪下這時核糖體已完成翻譯,蛋白已延著導肽途經穿過膜。鹽沖洗過的膜不能啟動核糖體的結合,取消鹽洗,它的能力又可以恢復。鹽洗的活性成分叫做信號識別蛋白(signalrecognitionparticle,SRP)。它是一個寬5-6nm,長23-24nm長條狀的結構,且能分離出11SRNP複合體,含有6種蛋白(總分子量為240KDa)和一個小的7SRNA(305鹼基,100KDa)此7SRNA提供此蛋的結構骨架,沒有這個骨架單個的蛋白不能裝配。
功能
SRP(信號肽識別粒子)有三個重要的功能:
(1)它能和新生的分泌蛋白的信號肽相結合;(2)還能和位於膜上的蛋白受體相結合;(3)延伸制動。
 信號肽
信號肽SRP活性能在體外由單個成分獲得再生。其實有功能的SRP可由一種7SRNA和其它一些蛋白組裝而成。像其它轉運和越膜蛋白一樣,SRP普遍存在於真核生物中。
SRP和SRP受體二者的催化功能是將帶有新生肽的核糖體轉移到膜上。第一步是信號肽被SRP識別。然後SRP和其受體結合,核糖體結合到膜上。SRP受體在蛋白質轉運中的作用是短暫的。當SRP和信號肽結合時,它阻止了翻譯。蛋白合成停止。此是新合成的多肽鏈長70aa左右時發生的。(這樣25-30殘基的信號肽伸在核糖體外面,相鄰的約40個aa仍在核糖體中)。
當SRP與其受體結合時,SRP釋放出信號肽,然後核糖體和膜上的其它成分(尚未鑑別出)結合,此時翻譯得到恢復。當核糖體被傳遞到膜上時,SRP及其受體的作用已完成了,又進入新的循環。再自由地發動另一些新生肽和膜的結合。
此SRP7SRNA可分成兩部分:5′端的100個鹼基和3′端的45個鹼基,這一段和AluRNA順序密切相關,因此定義為Alu結構域(Aludomoin)。RNA餘下的部分由SRNA功能域(sRNAdomain)構成。
RNP不同的部位對於靶蛋白具有相應三種功能。在體外用SRP的識別來研究每部分的功能。54KDa的蛋白只有一個分子,它不直接和RNA結合。而是和19KDa的蛋白結合,19KDa蛋白與RNA的兩個未端結合。P54用來識別信號肽;P68/72雙體結合於RNA的中心區域,它是用來識別SRP的受體及蛋白的越膜轉運。P9/14二聚體結合在此RNA分子另一端的附近。它負責延伸制動。
SRP的受體是含有72Kda和30KDa兩個亞基的二聚體。大亞基的N-端錨定在ER中,蛋白的大部分伸在胞液中,蛋白的此區域的大部分順序與核結合蛋白相似,帶有很多正電荷的aa,表明SRP受體識別SRP中的7SRNA,SRP受體小亞基的功能現在還不清楚。
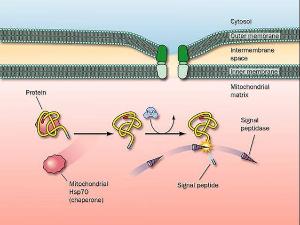
為什麼協同翻譯的蛋白進入內皮網狀系統,而翻譯後轉運的蛋白就要進入線粒體和葉綠體呢?還沒有充分的證據來明確回答此問題,且在酵母中輸入ER的蛋白卻發生在翻譯後轉運,這使問題更為突出。兩種過程對能量的需求是不同的。轉運到線粒體或葉綠中需要一種電位差,而進入ER時需ATP。這並不意味著蛋白系統的作用涉及到能量的提供。核糖體的存在對於在協同翻譯轉運中維持蛋白進入膜中時的正確幾何形狀是需要的。
其它觀點
 信號肽
信號肽一種觀點認為越膜轉運所能涉及到蛋白構象的控制。若蛋白的順序足以能被釋放到胞質中的話,它產生的構象取決於含水的環境。以這種構象它可能不會穿過膜。SRP的能力是在核糖體和膜接觸前抑制翻譯,阻止蛋白釋放在含水的環境中。然而以這種方法控制構象也僅是在信號肽位於N-端的情況下,在其它情況下是不行的。因此越膜運輸還可能涉其到與轉運蛋白結合,直接影響到他們結構的一些因子。
信號肽酶(signalpeptidase)(在體外鑑別的)由6種蛋白組成的複合體。實際上只有其中的一種蛋白具有酶的活性,其它的蛋白可能起到修飾作用或者與形成一定的結構有關,如與在膜上的定位或形成膜上的通道有關。它們的量約和結合核糖體的量相等。表明它起到結構功能的作用。它位於ER膜的內表面上。表明信號肽在被切割前必須穿過膜。
膜上核糖體受體又稱為多肽轉運裝置(translocationmachinery)或核糖體親和蛋白(Ribophorin)。可能由於核糖體受體和核糖體接觸後,在膜上聚集而形成孔道,使信號肽及其相連的新生肽得以通過。此時SRP與其受體分離恢復游離狀。翻譯和轉運完成後,核糖體大、小亞基相互解離,核糖體也發生解聚,通道消失,ER的膜也恢復完整的脂雙層。
分泌表達
外源蛋白在宿主菌,如大腸桿菌中的表達形式多為細胞內不溶性表達(包涵體),少數為細胞外分泌表達。利用信號肽來引導外源蛋白定位分泌到細胞特定區間,提高可溶性,可避免因包涵體復性帶來的困難。目前研究採用的信號肽來自表達系統自身的信號序列或外源信號序列,或兩者兼而有之。研究表明,多種外源基因連線上信號肽後,在原核表達系統,如大腸桿菌、L型細菌、芽孢桿菌和乳酸桿菌中等都得到了分泌表達;信號肽也廣泛套用於真核表達系統如畢赤酵母和昆蟲桿狀病毒表達系統中