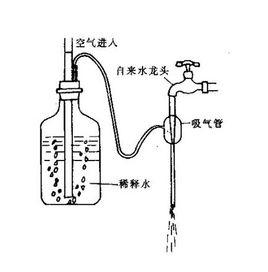
發現
1826年H·dela比拉迪埃用含有澱粉(指示劑)、氯化鈉和碳酸氫鈉的碘化物溶液為滴定劑,滴定次氯酸鈉溶液(漂白液),1840年有人以澱粉為指示劑,用碘的乙醇溶液為滴定劑,滴定硫化物溶液以後,碘量法套用日益廣泛。
定義
碘量法是氧化還原滴定法中,套用比較廣泛的一種方法。這是因為對I-I 的標準電位既不高,也不低,碘可做為氧化劑而被中強的還原劑(如Sn ,HS)等所還原;碘離子也可做為還原劑而被中強的或強的氧化劑(如HSO,IO ,CrO ,MnO 等)所氧化。
碘量法以碘作為氧化劑,或以碘化物(如碘化鉀)作為還原劑進行滴定的方法。
 碘量法
碘量法 方法概要
 碘量法
碘量法 原理:碘量法是利用的I氧化性和 I 的還原性為基礎的一種氧化還原方法。
基本半反應:I + 2e = 2 I
I 的 S 小:20 ℃為 1.33×10 mol/L
而I (水合) + I =I (配位離子) K = 710
過量I 存在時半反應。
極微量的碘與多羥基化合物澱粉相遇,也能立即形成深藍色的配合物,碘的這一性質是使碘量法得到套用。
滴定原理
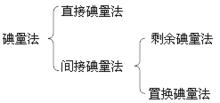
直接碘量法
直接碘量法是用碘滴定液直接滴定還原性物質的方法。在滴定過程中,I被還原為I:
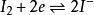 碘量法
碘量法 滴定條件:弱酸(HAc ,pH =5 )弱鹼(NaCO,pH =8)溶液中進行;如果溶液pH>9,可發生副反應使測定結果不準確。
強酸中: 4I + O(空氣中) + 4H = 2I+ HO
強鹼中: 3I+ 6OH =IO + 5I + 3HO
指示劑:1)澱粉,澱粉遇碘顯藍色,反應極為靈敏。化學計量點稍後,溶液中有過量的碘,碘與澱粉結合顯藍色而指示終點到達。2)碘自身的顏色指示終點,化學計量點後,溶液中稍過量的碘顯 黃色而指示終點。
可滴定物:I 是較弱的氧化劑,凡是E0’( E0 ) < 的物質都可用標準溶液直接滴定:
S 、SO 、SO 、AsO、Vc等。
間接碘量法
1)剩餘碘量法
剩餘碘量法是在供試品(還原性物質)溶液中先加入定量、過量的碘滴定液,待I與測定組分反應完全後,然後用硫代硫酸鈉滴定液滴定剩餘的碘,以求出待測組分含量的方法。滴定反應為:
I(定量過量)+ 還原性物質→2I + I(剩餘)
I(剩餘)+ 2SO →SO +2I
2)置換碘量法
置換碘量法是先在供試品(氧化性物質)溶液中加入碘化鉀,供試品將碘化鉀氧化析出定量的碘,碘再用硫代硫酸鈉滴定液滴定,從而可求出待測組分含量。滴定反應為:
氧化性物質 + 2I →I
I+ 2SO →SO + 2I
間接碘量法:
指示劑:澱粉,澱粉指示劑應在近終點時加入,因為當溶液中有大量碘存在時,碘易吸附在澱粉表面,影響終點的正確判斷。
滴定條件:在一定條件下,用I-還原氧化性物質,然後用 NaSO標準溶液滴定析出的碘。(此法也可用來測定還原性物質和能與 CrO 定量生成沉澱的離子)
間接碘量法的反應條件和滴定條件:
①酸度的影響—— I 與NaSO應在中性、弱酸性溶液中進行反應。
若在鹼性溶液中:SO + 4I + 10 OH = 2SO + 8I + 5HO
3I + 6OH =IO + 5I + 3HO
若在酸性溶液中:SO + 2H = 2SO + Sˉ+ HO
4I + O (空氣中) + 4H = 2I + HO
②防止 I 揮發
i ) 加入過量KI(比理論值大2~3倍)與 I 生成I ,減少 I揮發;
ii ) 室溫下進行;
iii) 滴定時不要劇烈搖動。
③防止I 被氧化
i) 避免光照——日光有催化作用;
ii) 析出 I後不要放置過久(一般暗處5 ~ 7min );
iii) 滴定速度適當快。
可滴定物:I-是中等強度的還原劑。主要用來測定:E0’( E0 )
CrO 、CrO 、HO、 KMnO、IO 、Cu 、NO 、NO
例:CrO + 6I +14H +6e = 2Cr +3I+7HO
I+ 2 SO = 2 I + SO
影響因素
(1)適用 pH 2 ~ 9:澱粉指示劑在弱酸介質中最靈敏,pH>9時,I易發生歧化反應,生成IO、IO, 而IO、IO不與澱粉發生顯色反應,當pH