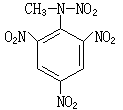
庫侖滴定法
原理 用強度一定的恆電流通過電解池,同時用電鐘記錄時間。由於電極反應,在工作電極附近不斷產生一種物質,它與溶液中被測物質發生反應。當被測定物質被“滴定”(反應)完了以後,由指示反應終點的儀器發出訊號,立即停止電解,關掉電鐘。按照法拉第電解定律,可由電解時間t和電流強度i計算溶液中被測物質的量W: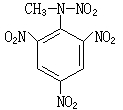
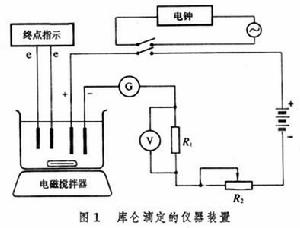
裝置 庫侖滴定裝置是一種恆電流電解裝置(圖 1,е為電極)。通過電解池的電流可由精密檢流計G顯示,也可由精密電位計測量標準電阻上的電壓而求得。電解池有兩對電極(圖 2),一對是指示終點的電極;另一對為進行庫侖測定的電極,其中與被測定物質起反應的電極稱工作電極,另一個稱輔助電極。為了防止兩個電極之間相互干擾,通常把輔助電極裝在玻璃套內,套管底部鑲上一塊微孔底板,上面放一層瓊脂或矽膠;或利用離子交換膜封閉套管,阻止離子出入。凡能指示一般電滴定法者,都可用來指示庫侖的滴定終點。
 庫侖滴定法
庫侖滴定法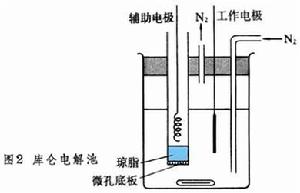 庫侖滴定法
庫侖滴定法負極:2H++2e─→H2
正極:2Br-─→Br2+2e
NH2—NH2+2Br2─→N2+4HBr
過量的Br2將指示劑氧化使之褪色,指示終點。停止電解,從電流和時間計算溶液中肼的含量。電位法 測定溶液中酸的濃度時,用玻璃電極和甘汞電極為指示電極,用pH計指示終點。鉑負極為工作電極,銀正極為輔助電極。電極反應為:
正極:2H++2e─→H2
負極:2Ag+2Cl-─→2AgCl+2e
死停終點法 用兩個鉑電極(圖3)
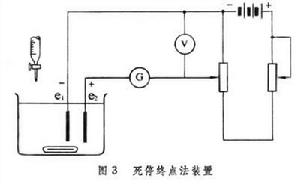 e1、e2為指示電極。在上面加一個小電壓(50毫伏或稍大一些)並線上路中串聯一個靈敏的檢流計G。 要使電流通過電解池,一個鉑電極上必須發生還原反應;另一個鉑電極上則發生氧化反應。如果溶液中同時存在一個氧化還原可逆電對的氧化態與還原態(如Fe3+與Fe2+;Br2與Br-),它的極譜曲線如圖4a所示,
e1、e2為指示電極。在上面加一個小電壓(50毫伏或稍大一些)並線上路中串聯一個靈敏的檢流計G。 要使電流通過電解池,一個鉑電極上必須發生還原反應;另一個鉑電極上則發生氧化反應。如果溶液中同時存在一個氧化還原可逆電對的氧化態與還原態(如Fe3+與Fe2+;Br2與Br-),它的極譜曲線如圖4a所示,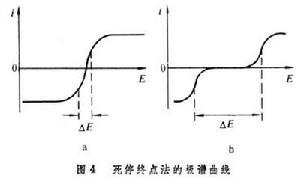 只要加上一個很小的電壓ΔE,就可使氧化態在e1上還原,還原態在e2上氧化,電流流過電解池。如果溶液中存在的氧化態與還原態不屬於同一個電對而屬於兩個電對〔如H+與As(Ⅲ)〕,則這時的極譜曲線如圖4b所示。要使電流通過圖 3的電解池,就需要比較大的電壓。如果在圖3的溶液中加入As(Ⅲ)和溴化鈉,然後用標準溴溶液滴定As(Ⅲ)。在等當點前溶液中只有Br-而沒有Br2,可逆對雙方不同時存在,外加電壓為50毫伏時不能使電流通過電解池。稍過滴定終點,溶液中既有Br-又有Br2,外加電壓雖小,也有電解發生,檢流計指針偏向一方,指示滴定終點。滴定過程中溶液中雖有As(Ⅲ)與As(Ⅴ),但在實驗條件下,兩者並非可逆電對,所以起不了可逆電對的作用。
只要加上一個很小的電壓ΔE,就可使氧化態在e1上還原,還原態在e2上氧化,電流流過電解池。如果溶液中存在的氧化態與還原態不屬於同一個電對而屬於兩個電對〔如H+與As(Ⅲ)〕,則這時的極譜曲線如圖4b所示。要使電流通過圖 3的電解池,就需要比較大的電壓。如果在圖3的溶液中加入As(Ⅲ)和溴化鈉,然後用標準溴溶液滴定As(Ⅲ)。在等當點前溶液中只有Br-而沒有Br2,可逆對雙方不同時存在,外加電壓為50毫伏時不能使電流通過電解池。稍過滴定終點,溶液中既有Br-又有Br2,外加電壓雖小,也有電解發生,檢流計指針偏向一方,指示滴定終點。滴定過程中溶液中雖有As(Ⅲ)與As(Ⅴ),但在實驗條件下,兩者並非可逆電對,所以起不了可逆電對的作用。 利用死停終點法指示庫侖滴定終點的例子是用電解產生的 Br2來滴定As(Ⅲ)。這時庫侖電解池的兩個工作電極都是鉑電極。在含As(Ⅲ)的溶液中加入溴化鈉和硫酸,電極上的反應為:
負極:2H++2e─→H2
正極:2Br-─→Br2+e
庫侖滴定是目前最準確的常量分析方法,又是高度靈敏的痕量成分測定方法。由於時間和電流都可準確地測量,庫侖滴定的精密度是很高的,常量成分測定的精密度可望達到二十萬分之幾。該法在它能夠套用的場合,比一般容量分析優越。它不需要製備標準溶液,因而不存在標準溶液的穩定性問題。它不需要測量體積,也不存在這方面的誤差。它比一般常量方法更容易自動化。在庫侖電解池中,通過電解產生的滴定劑有:H+、 OH-、Cl2、Br2、I2、 Ce(Ⅳ)、Ti(Ⅲ)、 Fe(Ⅱ)、Mn(Ⅱ)、Ag(Ⅰ)、Fe(CN)咶、Fe(CN)忹、CuBr娛、 Sn(Ⅱ)等。它們可滴定很多無機和有機物質。庫侖滴定最適合於分析那些在容量分析中用作基本標準的化學試劑。