溶液中的反應熱
正文
溶液中化學反應的熱效應。物質在溶液中可以發生各種不同類型的化學反應,同時產生各種熱效應。水解熱 水解反應是一個重要的化學過程,通常無副反應伴生,甚至室溫下也能很快完成。許多無機物和有機物都能發生水解反應,如鹽類、鹵化物、氫化物、硼的化合物、酸酐、酯類、金屬有機化合物、蛋白質等。水解反應的一般表示式為:
AD+H2O─→AH+DOH
上述化學過程的熱效應稱為水解熱 ΔHh。不少物質的水解熱很小,為了能進行精確測量,已有一些專用部件和微量量熱器出現,效果良好。絡合熱 是一定條件下中心離子M和配位體L在溶液中形成1摩爾絡合物MmLn所伴隨的熱效應。由於絡合過程是逐步進行的,絡合熱常常分步表示。一般來說,金屬離子與離子型配位體在水溶液中的絡合熱,多為0~±5千卡/摩爾;但也有一些較大,可達到10千卡/摩爾,如Ag(Ⅰ)或Hg(Ⅱ)與氰離子或碘離子的絡合。如果配位體是中性和一價的,其絡合熱常為-5~0千卡/摩爾。若中性配位體是多價的,則絡合熱可以增大至-20千卡/摩爾。
聚合熱 是指一定條件下 1摩爾單體生成聚合物過程的熱效應。聚合反應表示如下:
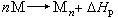
聚合熱的數值可由實驗方法進行測量,常用的方法有三種,即燃燒法、量熱器直接測量法和熱力學平衡法。此外,還有一些經驗性的估算和預測,只能作為近似的輔助方法。
參考書目
H.A.Skinner,Experimental Thermochemistry, Vol.Ⅱ,John Wiley & Sons, New York,1962.