概念簡介
 泡利
泡利自鏇為半整數的粒子(費米子)所遵從的一條原理。簡稱泡利原理。它可表述為全同費米子體系中不可能有兩個或兩個以上的粒子同時處於相同的單粒子態。電子的自鏇,電子遵從泡利原理。1925年W.E.泡利為說明化學元素周期律提出來的。原子中電子的狀態由主量子數n、角量子數l、磁量子數ml以及自鏇磁量子數ms所描述,因此泡利原理又可表述為原子內不可能有兩個或兩個以上的電子具有完全相同的4個量子數n、l、ml、ms。根據泡利原理可很好地說明化學元素的周期律。泡利原理是全同費米子遵從的一條重要原則,在所有含有電子的系統中,在分子的化學價鍵理論中、在固態金屬、半導體和絕緣體的理論中都起著重要作用。後來知道泡利原理也適用於其他如質子、中子等費米子。泡利原理是認識許多自然現象的基礎。最初泡利是在總結原子構造時提出一個原子中沒有任何兩個電子可以擁有完全相同的量子態。
一個由2個費米子組成的量子系統波函式完全反對稱。
歷史
早期
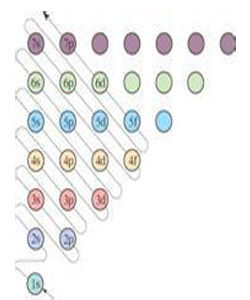
 電子-模型圖
電子-模型圖 1916年,吉爾伯特·路易斯在論文《原子與分子》(TheatomandtheMolecule)里表述出六條關於化學行為的假定,其中,第三條假定表明,“原子傾向於在每個電子層里維持偶數量的電子,更特別傾向於維持8個電子對稱性地排列於立方體的8個頂點。”但是,他並沒有試圖預測這模型會造成什麼樣的光譜線,而任何模型的預測都必須符合實驗結果
化學家歐文·朗繆爾於1919年提議,將每個電子層按照其主量子數分為個同樣體積的“細胞”,每個細胞都固定於原子的某個區域,除了最內部電子層的細胞只能容納1個電子以外,其它每個細胞都可容納2個電子。比較內部的電子層必須先填滿,才可開始填入比較外部的電子層。
1913年,尼爾斯·玻爾提出關於氫原子結構的波爾模型,成功解釋氫原子線譜,他又試圖將這理論套用於其它種原子與分子,但獲得很有限的結果。經過漫長九年的研究,1922年,玻爾才又完成關於周期表內各個元素怎樣排列的論述,並且建立了遞建原理,這原理給出在各個原子裡電子的排布方法──每個新電子會占據最低能量空位。但是,波爾並沒有解釋為什麼每個電子層只能容納有限並且呈規律性數量的電子,為什麼不能對每個電子都設定同樣的量子數?
鈉D線是因自鏇-軌道作用而產生的雙重線,波長分別為589.6nm、589.0nm。由於施加弱外磁場而產生的反常塞曼效應會使這雙重線出現更多分裂
*589.6nm的譜線是2P1/2態向2S1/2態躍遷產生的譜線。
*589.0nm的譜線是2P3/2態向2S1/2態躍遷產生的譜線。
由於弱外磁場作用,2S1/2態能級會分裂成兩個子能級,2P1/2態也會分裂成兩個子能級,但由於兩個態的朗德g因子不同,因此會形成4條不同譜線。由於外磁場作用,2P3/2態能級會分裂成四個子能級,但是從2P3/2的+3/2態不能躍遷至2S1/2的-1/2態,從2P3/2的-3/2態不能躍遷至2S1/2的+1/2態,因此總共會形成6條不同譜線。
泡利發展
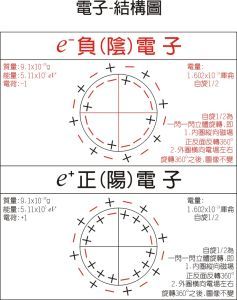
 質子、中子等費米子-模型圖
質子、中子等費米子-模型圖隔年,泡利任聘為漢堡大學物理講師,他開始研究形成閉合殼層的物理機制,認為這問題與多重線結構有關,因此他更加專注於研究鹼金屬的雙重線結構。按照那時由玻爾帶頭提倡的主流觀點,因為原子核的有限角動量,才會出現雙重線結構。泡利不贊同這論點,1924年,他發表論文表明,鹼金屬的雙重線結構是因為電子所擁有的一種量子特性,是一種無法用經典力學理論描述的“雙值性”。為此,他提議設定新的雙值量子數,只能從兩個數值之中選一個為量子數的數值。後來撒姆爾·高斯密特(SamuelGoudsmit)與喬治·烏倫貝克確認這性質是電子的自鏇。
電子排列
 泡利不相容原理
泡利不相容原理 1940年,泡利理論推導出粒子的自鏇與統計性質之間的關係,從而證實不相容原理是相對論性量子力學的必然後果。保羅·埃倫費斯特於1931年指出,由於泡利不相容原理,在原子內部的束縛電子不會全部掉入最低能量的原子軌道,它們必須按照順序占滿越來越高能量的原子軌道。因此,原子會擁有一定的體積,物質也會那么大塊。[10][11]:25,561-562。1967年,弗里曼·戴森與安德魯·雷納(AndrewLenard)給出嚴格證明,他們計算吸引力(電子與核子)與排斥力(電子與電子、核子與核子)之間的平衡,推導出重要結果:假若不相容原理原理不成立,則普通物質會坍縮,占有非常微小體積。
1964年,夸克的存在被提出之後不久,奧斯卡·格林柏格(OscarGreenberg)引入了色荷的概念,試圖解釋三個夸克如何能夠共同組成重子,處於在其它方面完全相同的狀態但卻仍滿足泡利不相容原理。這概念後來證實有用並且成為夸克模型(quarkmodel)的一部分。1970年代,量子色動力學開始發展,並構成粒子物理學中標準模型的重要成份。
名詞解釋
假如將任何兩個粒子對調後波函式的值的符號改變的話,那么這個波函式就是完全反對稱的。這說明兩個費米子在同一個系統中永遠無法占據同一量子態。由於所有的量子粒子是不可區分的,假如兩個費米子的量子態完全相同的話,那么在將它們對換後波函式的值不應該改變。這個悖論的唯一解是該波函式的值為零:比如在上面的例子中假如兩個粒子的位置波函式一致的話,那么它們的自鏇波函式必須是反對稱的,也就是說它們的自鏇必須是相反的。
該原理說明,兩個電子或者兩個任何其他種類的費米子,都不可能占據完全相同的量子態。通常也稱為泡利不相容原理(因奧地利物理學家泡利(1900~1958)而得名)。
套用範圍
泡利不相容原理對所有費米子(其自鏇數為半數的粒子)有效。費米子遵循費米-狄拉克統計。自鏇為整數的粒子被稱為玻色子。玻色子遵守玻色-愛因斯坦統計,泡利不相容原理對它們無效。玻色子可以占據相同的量子態。
名稱由來
這是由奧地利物理學家泡利(1900~1958)而得名。1924年,泡利發表了他的“不相容原理”:原子中不能有2個電子處於同一量子態上。這一原理使得當時所知的許多有關原子結構的知識變得有條有理。這就是“泡利原理”,即泡利不相容原理。泡利本人獲得了1945年度的諾貝爾物理學獎。簡單來說,泡利原理就是電子除空間運動狀態外,還有一種狀態叫做自鏇。電子自鏇不可以簡單地比喻成球的自轉,而是電子的固有屬性(內秉屬性),是空間外的另一個維度的物理量。電子自鏇有兩種狀態,常用上下箭頭表示自鏇狀態相反的電子。在一個原子軌道里,最多只能容納兩個電子,而且它們的自鏇狀態相反,這就是由泡利首先提出的,並以其名字命名的泡利原理。我們知道電子是帶負電荷的物質粒子,而什麼是電荷及電荷的本質是什麼,為什麼物質會帶電,電與什麼物理量有關的這個基本概念,是至今我們也沒有弄明白的一個基本概念。而我們所接受的電荷的所有基本概念和基本理論,全來自於庫侖的物理實驗和庫侖定律。而每當我打開這些理論書籍,想去尋求這些答案時,就會非常失望。因此弄不清物質的質量來源和帶電本質,是造成我們無法去統一物質之間的四種基本力的最大障礙。而愛因斯坦的質能公式和普朗克量子能量理論及正反物質能夠相互湮滅的事實,就已經回答了這些問題。
如果弄清了這二個最基本理論問題,就可以弄請電子為什麼自鏇及電子自鏇的角動量是從何而來的道理。就可以避免得出相互排斥的電子可以形成化學鍵,違反庫侖定律的結論。也可解釋相互排斥的質子為什麼可以形成原子核的原因。
上述的泡利不相容原理,不是定理,就已說明它沒有理論依據。但得出的結論卻與用愛因斯坦和普郎克量子能量理論得出的結論是一致的,就證明了它的正確。而它的意義就在於能夠解決很多的理論問題。
有愛因斯坦的質能公式和普朗克的量子能量公式和正反物質相互湮滅的實驗結果為依據,這都成為光與原子物理教科書中的最基本的概念。