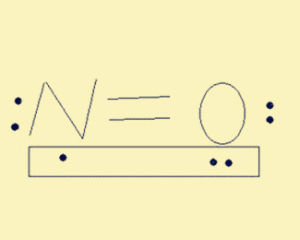
分子結構
 一氧化氮分子圖
一氧化氮分子圖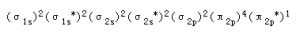
反鍵軌道上(π2p*)1易失去生成亞硝醯陽離子NO+ :
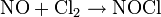
可以二聚生成(NO)2,在固態中少量存在:

理化性質
物理性質
 一氧化氮
一氧化氮鍵解離能:941.69kJ/mol
磁性:順磁性
禁配物:易燃或可燃物、鋁、鹵素、空氣、氧
避免接觸的條件:受熱
聚合危害:與氧氣聚合形成腐蝕性二氧化氮
分解產物:氮氣,氧氣,還有少量一氧化二氮
化學性質
還原性一氧化氮易被氧化生成二氧化氮,處於空氣中的一氧化氮很快會被空氣中的氧氣氧化生成紅棕色二氧化氮。工業上可用此法生產硝酸 。
配位性
由於孤對電子的存在,一氧化氮易與金屬離子形成配合物。可與血紅蛋白結合,使人窒息中毒。
如一氧化氮可與Fe2+ 生成棕色亞硝醯亞鐵離子,稱為棕色環反應,為檢驗亞鐵離子的反應之一:
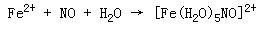
生物活性
一氧化氮起著信使分子的作用。當內皮要向肌肉發出放鬆指令以促進血液流通時,它就會產生一氧化氮分子,這些分子很小,能很容易地穿過細胞膜。血管周圍的平滑肌細胞接收信號後舒張,使血管擴張。在心血管中,一氧化氮對維持血管張力的恆定與調節血壓穩定起著重要作用。硝酸甘油治療心絞痛正是由於其在體內轉化成NO,擴張血管 。
一氧化氮也能在神經系統的細胞中發揮作用,促進學習、記憶過程,並可調節腦血流。它對周圍神經末梢所起的作用,正是西地那非功能的基礎。大腦通過周圍神經發出信息,向會陰部的血管提供相應的一氧化氮,引起血管的擴張,增加血流量,從而增強勃起功能。在一些情況下,勃起無力是由於神經末梢產生的一氧化氮較少所致。西地那非能擴大一氧化氮的效能,從而增強勃起功能。
免疫系統產生的一氧化氮分子,不僅能抗擊侵入人體的微生物,而且還能夠在一定程度上阻止癌細胞的繁殖,阻止腫瘤細胞擴散。NO起殺傷細菌、病毒、腫瘤細胞的作用。相關研究證明,當吸入性一氧化氮濃度達到100ppm至200ppm的劑量時,具有有效的抗菌作用,且沒有明顯的副作用。加拿大一些監管部門已經批准將其作為肺血管擴張劑用於治療新生兒疾病。
製備方法
實驗室用銅與稀硝酸共熱製取一氧化氮:

工業上用氨氣在鉑(石棉載體)或鉑銠合金網催化下氧化生成一氧化氮,這是工業上制硝酸的重要反應:
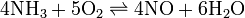
健康危害
一氧化氮不穩定,在空氣中很快轉變為二氧化氮產生刺激作用。氮氧化物主要損害呼吸道。吸入初期僅有輕微的眼及呼吸道刺激症狀,如咽部不適、乾咳等。常經數小時至十幾小時或更長時間潛伏期後發生遲發性肺水腫、成人呼吸窘迫綜合徵,出現胸悶、呼吸窘迫、咳嗽、咯泡沫痰、紫紺等。可並發氣胸及縱隔氣腫。肺水腫消退後兩周左右可出現遲發性阻塞性細支氣管炎。一氧化氮濃度高可致高鐵血紅蛋白血症。
慢性影響:主要表現為神經衰弱綜合徵及慢性呼吸道炎症。個別病例出現肺纖維化。可引起牙齒酸蝕症。
應急處理
急救措施
吸入一氧化氮:應迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
消防措施危險特性:一氧化氮具有強氧化性。與易燃物、有機物接觸易著火燃燒。遇到氫氣爆炸性化合。接觸空氣會散發出棕色有氧化性的煙霧。一氧化氮較不活潑,但在空氣中易被氧化成二氧化氮,而後者有強烈毒性。
有害燃燒產物:氧化氮。
滅火方法: 消防人員必須穿全身防火防毒服,在上風向滅火。切斷氣源。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:霧狀水。
泄漏應急處理迅速撤離泄漏污染區人員至上風處,並立即隔離150m,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑收容產生的大量廢水。漏氣容器要妥善處理,修復、檢驗後再用。
消防措施
危險特性:具有強氧化性。與易燃物、有機物接觸易著火燃燒。遇到氫氣爆炸性化合。接觸空氣會散發出棕色有酸性氧化性的棕黃色霧。一氧化氮較不活潑,但在空氣中易被氧化成二氧化氮,而後者有強烈腐蝕性和毒性。
有害燃燒產物:氧化氮。
滅火方法:消防人員必須穿全身防火防毒服,在上風向滅火。切斷氣源。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:霧狀水。
接觸控制
職業接觸限值
中國MAC(mg/m3):5NO2
前蘇聯MAC(mg/m3):5
TLVTN:ACGIH25ppm,31mg/m3
TLVWN:未制定標準
監測方法:鹽酸萘乙二胺比色法
工程控制:嚴加密閉,提供充分的局部排風和全面通風。提供安全淋浴和洗眼設備。
呼吸系統防護:空氣中濃度超標時,佩戴自吸過濾式防毒面具(半面罩)。緊急事態搶救或撤離時,建議佩戴空氣呼吸器。
眼睛防護:戴化學安全防護眼鏡。
身體防護:穿透氣型防毒服。
手防護:戴防化學品手套。
其他防護:工作現場禁止吸菸、進食和飲水。保持良好的衛生習慣。
理化特性
主要成分:純品
外觀與性狀:無色氣體。
pH:
熔點(℃):-163.6
沸點(℃):-151
相對密度(水=1):1.27(-151℃)
溶解性:微溶於水。
主要用途:制硝酸、人造絲漂白劑、丙烯及二甲醚的安定劑。
其它理化性質:
一氧化氮是無色氣體,工業製備他是在鉑網催化劑上用空氣將氨氧化的方法;實驗室中則用金屬銅與稀硝酸反應。
NO在水中的溶解度較小,而且不與水發生反應。常溫下NO很容易氧化為二氧化氮,也能與鹵素反應生成鹵化亞硝醯(NOX)如2NO+Cl2=2NOCl
但NO與O2可與水反應,化學方程式為4NO+3O2+2H2O=4HNO3
根據NO的分子結構可見,他有未成對的電子,兩個原子共有11個價電子,也就是個奇分子,大多數奇分子都有顏色,然而NO僅在液態或固態時才呈藍色。NO分子在固態時會締合成鬆弛的雙聚分子(NO)2,這也是他具有單電子的必然結果。這裡需要特別說明的是,NO可以被過氧化鈉吸收3
Na2O2+2NO=2NaNO2
所以所有中學習題中關於含NO氣體通過過氧化鈉(而NO不被吸收)的內容都是錯誤的,是不負責任的出題者胡亂編造的。
操作儲存
操作注意事項:嚴加密閉,提供充分的局部排風和全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防毒面具(半面罩),戴化學安全防護眼鏡,穿透氣型防毒服,戴防化學品手套。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與鹵素接觸。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
儲存注意事項: 儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與易(可)燃物、鹵素、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備。
運輸注意事項
鐵路運輸時須報鐵路局進行試運,試運期為兩年。試運結束後,寫出試運報告,報鐵道部正式公布運輸條件。採用剛瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。嚴禁與易燃物或可燃物、鹵素、食用化學品等混裝混運。夏季應早晚運輸,防止日光曝曬。公路運輸時要按規定路線行駛,禁止在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
穩定性和反應活性
穩定性:較穩定禁配物:易燃或可燃物、鋁、鹵素、空氣、氧。
避免接觸的條件:受熱。
聚合危害:與氧氣聚合形成腐蝕性二氧化氮
分解產物:氮氣,氧氣,還有少量一氧化二氮
毒理學資料
急性毒性:LD50:無資料LC50:1068mg/m3,4小時(大鼠吸入)
亞急性和慢性毒性:
刺激性:中
致敏性:較高
致突變性:輕微
致畸性:輕微
致癌性:無
生態學資料
生態毒理毒性:生物降解性:
非生物降解性:
生物富集或生物積累性:不明顯
其它有害作用:該物質對環境有危害,應特別注意對地表水、土壤、大氣和飲用水的污染。
廢棄處置
廢棄處置方法:根據國家和地方有關法規的要求處置。或與廠商或製造商聯繫,確定處置方法。套用及使用安全
一氧化氮的套用及使用安全
一、化學工業1901年開始用電弧法自空氣中製取氮氧化物。在電弧的作用下,使氮和氧直接化合成一氧化氮,再進一步加工製成硝酸。根據佛山科的氣體有限公司多年的經驗,將其套用總結如下:一氧化氮是製造硝酸的重要的中間產物,在硝酸生產中,一氧化氮被氧化為二氧化氮,再與水反應生成硝酸。
一氧化氮也可用於硝化生產工藝,它可與烯烴加成,生成二亞硝基化合物,後者可被氧化為硝基化合物。
聚氯乙烯行業的聚合反應中止劑。一氧化氮
二、電子工業一氧化氮主要用於電子工業中的矽氧化膜形成、氧化、化學氣相沉積。
三、航天工業一氧化氮可用於航天火箭和衛星的推進劑。
四、計量標準氣、校正氣標準氣、校正氣、大氣檢測混合氣。環保檢測。
五、生命科學和醫療一氧化氮在生命科學與醫療界受到前所未有的重視。研究發現,一氧化氮在人體若干生理、病理過程中起著十分重要的作用,在免疫及神經等科學專家的努力下,其作用機制不斷被闡明,並不斷獲得新的認識。近幾年檢驗及藥學專家也參與進來,使一氧化氮在臨床實驗輔助診斷及治療方面發揮作用,並已逐步顯示出其臨床套用前景。初步研究表明,一氧化氮幾乎在生命活動的每一步,例如血管和氣管平滑肌的舒張、中樞和自律神經的傳遞、細菌的殺傷、腫瘤細胞的融解、內分泌激素的釋放、機體免疫防禦、吸收功能的調節等過程中,均發生功能作用。一氧化氮是生命體內重要的信使分子、效應分子和免疫調節分子的觀點,已為學術界所廣泛接受。
一氧化氮在疾病治療中的套用包括兩個方面:一是直接輸入氣體一氧化氮(如吸入一氧化氮緩解肺動脈高壓與呼吸窘迫),或利用一氧化氮供體產生一氧化氮作用於靶器官或組織(如冠心病、心肌缺血、內毒素性休克、肺動脈高壓及陽痿等),從而起到緩解或治療作用。一氧化氮供體目前主要有:硝酸酶類、呋喃惡烷類、亞硝基硫醇類、斯德硐亞胺類、硝普納等。二是加入相關藥物調節機體一氧化氮的生成速度,如L-精氨是合成一氧化氮的前體,對許多疾病(心血管疾病如高血壓、高膽固醇血症、充血性心力衰竭等,腎臟疾病如急性腎衰、阻塞性腎病、慢性腎病及胃黏膜潰瘍等)具有有益的治療作用;一氧化氮抑制劑如L-單甲基-精氨酸(L-NMMA)、L-硝基-精氨酸(L-NNA)、L-硝基精氨酸甲醋(L-NAME)等可抑制體內一氧化氮的生成,對於由於一氧化氮生成過多而致的疾病具有治療或緩解作用。已有研究表明,一氧化氮還參與了許多藥物如血管緊張素轉化酶抑制腺苷、硫酸鎂、嗎啡、Ca2+ATPase抑制劑,白血胞介素、腫瘤壞死因子、前列腺素類藥物等的藥理作用機制。
一氧化氮的使用安全
急救措施:迅速離開污染區,送醫院救治。
泄漏應急處理:關閉污染源,用鹼水或鹼石砂吸收泄漏氣體開將泄漏容器移人通風櫥中。
操作人員必須經專門培訓。工作時應穿工作服,戴防護眼鏡及手套。生產設備嚴加密閉,提供充分的局部和全部排風。當空氣中濃度超標時,必須佩戴防毒面具,必要時佩戴正壓自給式呼吸器。定期進行肺部檢查。
消防用乾粉、二氧化碳滅火器撲救。
法規信息
化學危險物品安全管理條例(1987年2月17日國務院發布),化學危險物品安全管理條例實施細則(化勞發1992677號),工作場所安全使用化學品規定(1996勞部發423號)等法規,針對化學危險品的安全使用、生產、儲存、運輸、裝卸等方面均作了相應規定;常用危險化學品的分類及標誌(GB13690-92)將該物質劃為第2.3類有毒氣體;劇毒物品分級、分類與品名編號(GA57-93)中,該物質的液化或壓縮品被劃為第一類A級無機劇毒品。
與人體功能
一氧化氮(nitricoxide,NO)廣泛分布於生物體內各組織中,特別是神經組織中。它是一種新型生物信使分子,1992年被美國Science雜誌評選為明星分子。NO是一種極不穩定的生物自由基,分子小,結構簡單,常溫下為氣體,微溶於水,具有脂溶性,可快速透過生物膜擴散,生物半衰期只有3-5s,其生成依賴於一氧化化氮合成酶(nitricoxidesynthase,NOS)並在心、腦血管調節、神經、免疫調節等方面有著十分重要的生物學作用。因此,受到人們的普遍重視。
NO生物活性的發現
醫學知識告訴我們,有兩種重要的物質作用於血管平滑肌,它們分別是去甲腎上腺素和乙醯膽鹼。去甲腎上腺素通過作用於血管平滑肌細胞受體而使其收縮。對於乙醯膽鹼是如何作用於血管平滑肌使之舒張,其途徑尚不清楚,醫學界一起在致力於研究。
1980年,美國科學家Furchgott在一項研究中發現了一種小分子物質,具有使血管平滑肌鬆弛的作用,後來被命名為血管內皮細胞舒張因子(endothelium-derivedrelaxingfactor,EDRF)是一種不穩定的生物自由基。並進入相鄰平滑肌細胞,在平滑肌細胞內,EDRF激活鳥苷酸環化酶,導致cAMP水平升高,cAMP激活PKG,使平滑肌鬆弛,然而,EDRF被確認為是NO。眾所周知,硝酸甘油是治療心膠痛的藥物,多年來人們一直希望從分子水平上弄清楚其治療機理。近年的研究發現,硝酸甘油和其它有機硝酸鹽本身並無活性,它們在體內首先被轉化為NO,是NO刺激血管平滑肌內cGMP形成而使血管擴張,這種作用恰好同EDRF具有相似性。1987年,Moncada等在觀察EDRF對血管平滑肌舒張作用的同時,用化學方法測定了內皮細胞釋放的物質為NO,並據其含量,解釋了其對血管平滑肌舒張的程度。1988年,Polmer等人證明,L-精氨酸(L-argi-nine,L-Arg)是血管內皮細胞合成NO的前體,產物是瓜氨酸和NO,過程由NO合酶(nitricoxidesynthase,NOS)催化4,從而確立了哺乳動物體內可以合成NO的概念。
NO的生物學作用
⑴在心血管系統中的作用
NO在維持血管張力的恆定和調節血壓的穩定性中起著重要作用。
在生理狀態下,當血管受到血流衝擊、灌注壓突然升高時,NO作為平衡使者維持其器官血流量相對穩定,使血管具有自身調節作用。能夠降低全身平均動脈血壓,控制全身各種血管床的靜息張力,增加局部血流,是血壓的主要調節因子。
NO在心血管系統中發揮作用的可能機制是通過提高細胞中鳥苷酸環化酶(guanylatecyclase,GC)的活性,促進磷酸鳥苷環化產生環一磷酸鳥苷(guanosine3′,5′–cyclicmonophosphatecGMP),使細胞內cGMP水平增高,繼而激活依賴cGMP的蛋白激酶對心肌肌鈣蛋白Ⅰ的磷酸化作用加強,肌鈣蛋白c對Ca2+的親合性下降,肌細胞膜上K+通道活性也下降,cGMP的蛋白激酶增強,從而導致血管舒張。
⑵在免疫系統中的作用
研究結果表明,NO可以產生於人體內多種細胞。如當體內內毒素或T細胞激活巨噬細胞和多形核白細胞時,能產生大量的誘導型NOS和超氧化物陰離子自由基,從而合成大量的NO和H2O2,這在殺傷入侵的細菌、真菌等微生物和腫瘤細胞、有機異物及在炎症損傷方面起著十分重要的作用。
當前認為,經激活的巨噬細胞釋放的NO可以通過抑制靶細胞線粒體中三羧酸循環、電子傳遞細胞DNA合成等途徑,發揮殺傷靶細胞的效應。
免疫反應所產生的NO對鄰近組織和能夠產生NOS的細胞也有毒性作用。某些與免疫系統有關的局部或系統組織損傷,血管和淋巴管的異常擴張及通透性等,可能都與NO在局部的含量有著密切的關係。
⑶在神經系統中的作用
有關L-Arg→NO途徑在中樞神經系統(CNS)方面的研究認為,NO通過擴散,作用於相鄰的周圍神經元如突出前神經末梢和星狀膠質細胞,再激活GC從而提高水平cGMP水平而產生生理效應。如NO可誘導與學習、記憶有關的長時程增強效應(Long-termpotentiation,LTP),並在其LTP中起逆信使作用。
連續刺激小腦的上行纖維和平行纖維可引起平行纖維細胞的神經傳導產生長時程抑制(Long-termdepression,LTD),被認為是小腦運動學習體系中的一種機制,NO參與了該機制。
在外周神經系統也存在L-Arg→NO途徑。NO被認為是非膽鹼能、非腎上腺素能神經的遞質或介質,參與痛覺傳入與感覺傳遞過程。
NO在胃腸神經介導胃腸平滑肌鬆弛中起著重要的中介作用,在胃腸間神經叢中,NOS和血管活性腸肽共存並能引起非腎上腺素能非膽鹼能(nonadrenergic-non-cholinerrgic,NANC)舒張,但血管活性腸肽的抗體只能部分消除NANC的舒張,其餘的舒張反應則能被N-甲基精氨酸消除。
⑷在泌尿及生殖系統中的作用
一氧化氮作為NANC神經元遞質,在泌尿生殖系統中起著重要作用,成為排尿節制等生理功能的調節物質,這為藥物治療泌尿生殖系統疾病提供了理論依據。
現已證明在人體內廣泛存在著以NO為遞質的神經系統,它與腎上腺素能、膽鹼能神經和肽類神經一樣重要。若其功能異常就可能引起一系列疾病。
NO的化學行為
NO在常溫下為氣體,具有脂溶性是使它在人體內成為信使分子的可能因素之一。它不需要任何中介機制就可快速擴散通過生物膜,將一個細胞產生的信息傳遞到它周圍的細胞中,主要影響因素是它的生物半壽期。具有多種生物功能的特點在於它是自由基,極易參與與傳遞電子反應,加入機體的氧化還原過程中。分子的配位性又使它與血紅素鐵和非血紅素鐵具有很高的親合力,以取代O2和CO2的位置。據研究報導,血紅蛋白-NO可以失去它附近的鹼基而變成自由的原血紅素-NO,這就意味著自由的鹼基可以自由地參與催化反應,自由的蛋白質可以自由地改變構象,自由的血紅素可以自由地從蛋白中擴散出去,這三種變化中的任何一個或它們的組合,將在鳥苷酸環化酶的活化過程中起重要作用。NO的生物學作用和其作用機制研究方興未艾,它的發現提示著無機分子在醫學領域中研究的前景。筆者相信還會有更多的無機分子在人體內被發現、被研究、被套用於促進人類健康的研究領域中。
一氧化氮是太空人暈厥發作的元兇
一氧化氮的過量產生會使血管擴張,這樣就可以解釋為什麼太空人在太空飛行之後會產生暈厥,以及可以解釋許多陸地上發生的類似現象。
這種太空中太空人經歷的微重力現象,很象太空中的太空人或長期久臥在床的病人馬上要起來時的感覺,這時人們會產生過多的血管擴張劑--一氧化氮,從而導致血壓降低,流往頭部的血液減少,出現暈厥。
在對大鼠的試驗中,加州大學的研究人員發現,低重力環境下,大鼠產生一氧化氮的兩種酶增多,而且,給予大鼠藥物抑制其中一種酶時,它們的血壓升高,這給研究人員一個提示:抑制一氧化氮對太空人和長期臥床患者的暈厥是一種有效的治療。這份研究報告發表在7月份出版的《實用生理學》雜誌上。
在我們正常的直立的生活中,重力使血液流往下肢,因此身體下部的血管收縮以確保有足夠的血液流往相反的方向。在低重力環境下,人全身的血壓一樣,當太空人返回地球時,他們身體下部過度舒張的血管使頭部血壓急劇下降,於是在站立時,不可避免地要暈倒。
人們看到太空人登入後輕鬆地大步行走,是因為他們穿著加壓的衣服,能保持健康的血壓。但是,他們的衣服只能穿這么久,而適應重力需要一段時間。
長期臥床的患者其情況與太空人相似,好像不受重力的影響。因此,在試圖站立時會暈倒。"
實驗室製法
一氧化氮
1.製備方法
5實驗室用銅與稀硝酸反應來製取一氧化氮。
2.化學方程式
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
3.收集方法
排水法。(由於一氧化氮易與空氣中氧氣發生反應,從而被氧化成二氧化氮,所以一氧化氮不可採用向上排空氣法收集,必須採用排水法來收集。)
無機氮化合物
氨 | 聯氨 | 三氟化氮 | 三氯化氮 | 氧氯化氮 | 一氧化二氮 | 一氧化氮 | 三氧化二氮 | 二氧化氮 | 四氧化二氮 | 五氧化二氮 | 亞硝酸 | 連二亞硝酸 | 亞硝酸 | 過氧亞硝酸 | 硝酸 | 過硝酸