簡介
泛素-蛋白酶體系統(ubiquitinproteasomesystem,UPS)是細胞內蛋白質降解的主要途徑,參與細胞內80%以上蛋白質的降解。發現
1970年代末和1980年代初,泛素-蛋白酶體系統在以色列技術工程學院(Technion–IsraelInstituteofTechnology)阿夫拉姆·赫什科的實驗室中發現,由於他在發現泛素-蛋白酶體系統上的貢獻,阿夫拉姆·赫什科獲得了2004年度的諾貝爾化學獎。結構
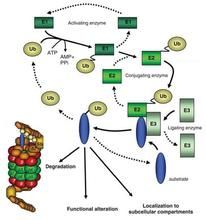
 泛素-蛋白酶體系統
泛素-蛋白酶體系統①泛素:含有76個胺基酸殘基,分子量約8.5kDa,廣泛存在於真核細胞(原核細胞中尚未發現)。泛素鏈與蛋白底物的結合形成被蛋白酶體降解的識別信號。另外,泛素化在蛋白的內吞和外泌作用中有目標定位功能。
②泛素活化酶E1:通過半胱氨酸殘基與泛素C端活化的甘氨酸殘基形成硫酯鍵,E1-泛素中間體中的泛素可以轉移給數個E2。
③泛素結合酶E2:以泛素結合酶方式起作用,活性部位為半胱氨酸,部分E2成員在細胞特定過程中發揮作用,但E2的全部作用尚不清楚。
④泛素連線酶E3:為泛素-蛋白酶體系統選擇性降解機制的關鍵因素,識別被降解的蛋白並將泛素連線到底物上。
⑤蛋白酶體(2.5MDa):由2個19S和1個20S亞單位組成的桶狀結構,19S為調節亞單位,位於桶狀結構的兩端,識別多聚泛素化蛋白並使其去摺疊。19S亞單位上還具有一種去泛素化的同功肽酶,使底物去泛素化。20S為催化亞單位,位於兩個19S亞單位的中間,其活性部位處於桶狀結構的內表面,可避免細胞環境的影響。酵母20S亞單位由四個環狀結構(αββα)組成。
作用
UPS是細胞內一系列生命進程的重要調節方式,與疾病的發生髮展關係密切。研究證實泛素-蛋白酶體系統在心血管疾病中具有重要的病理生理學意義,可調節動脈粥樣硬化、缺血後再灌注損傷、家族性心肌病、心肌肥厚和心臟衰竭等重要疾病的發生和發展。
另外,最新的研究表明,UPS的重要作用還在於其被充分利用後,可以代謝諸如毒素、脂肪、癌細胞在內的人體垃圾,另外代謝產生的能量可刺激細胞進行自我複製以完成人體的自我代謝修復功能。