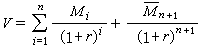格利雅試劑
格利雅試劑廣泛用於有機合成中,從RMgX可以製取RH、 R-COOH、R-CHO、R-CH2OH、R-OH、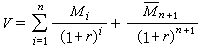 、
、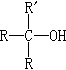 、
、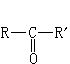 和RnM(R為烴基,n為金屬的化合價,M為其他金屬)。在合適的情況下,RMgX還能與α、β-不飽和羰基化合物發生共軛的加成反應。
和RnM(R為烴基,n為金屬的化合價,M為其他金屬)。在合適的情況下,RMgX還能與α、β-不飽和羰基化合物發生共軛的加成反應。 格利雅試劑的確切組成還不能完全肯定,分子中肯定有醚的配位,如果醚的配位解體,就不成為格利雅試劑。在格利雅試劑中加入1,4-二烷,則氯化鎂被沉澱出來,溶液中主要是醚合的R2Mg。在乙醚中,氯化鎂又可與R2Mg配位而得到醚合的RMgX。格利雅試劑溶液中呈一種平衡狀態,稱為許倫克平衡:
2RMgX  R2Mg+MgX2
R2Mg+MgX2
氯乙烯和結合在烯碳上的氯不能在乙醚中與鎂反應,如用四氫呋喃代替乙醚,可以製得氯化乙烯基鎂試劑。這種試劑有人稱之為諾曼試劑。
為了更好地啟動鎂與鹵代烴的反應,可用少量1,2-二溴乙烷代替碘,特別是乙醚中如有少量水時,二溴乙烷與鎂很快反應,生成溴化鎂和乙烯,溴化鎂有去水乾燥作用,新鮮的鎂與給定的鹵代烴就可反應生成需要的格利雅試劑,而不發生碘代烴的副反應。這種啟動反應叫做製備格利雅試劑的夾帶方法。
乙炔或其他端基炔烴與乙基格利雅試劑發生金屬化反應,得到乙烷和炔基鎂油狀不溶性物,後者可溶於四氫呋喃中,作格利雅試劑用。
參考書目
A. N. Nesmeyanov, ed.,Handbook of Magnesium Organic Compounds,Pergamon, London, 1958.