反應簡介
1912年,法國化學家格利雅(Victor Grignard)因發展了有機鎂試劑及其參與的反應在有機合成中的套用而獲得了諾貝爾化學獎,有機鎂試劑也稱為格氏試劑,格氏試劑參與的反應被稱為格氏反應,這也許是眾多化學黨們學習的第一個經典人名反應。格利雅是在他的老師Barbier的工作基礎上發展的格氏試劑和格氏反應,相比Barbier反應,格氏反應操作更簡便,套用更廣泛,是非常重要的碳碳鍵生成方法。值得一提的是,這裡還體現了極性翻轉的化學思想,即親電性的鹵代烷在和金屬鎂作用後,生成了親核性極強的格氏試劑,可以和各種常見的親電試劑如醛、酮、亞胺、酯、環氧、二氧化碳等發生反應,套用非常廣泛。
格氏試劑的製備
1、格氏試劑的傳統製法也是眾多有機化學親們必須掌握的方法:鹵代烴和金屬鎂在乾燥的乙醚或者四氫呋喃中製備,加熱引發,有時候需要加入碘幫助引發。這也是套用最多的格氏試劑製備方法。
2、金屬-鹵素交換:比如說碘鎂交換,即用碘苯衍生物和異丙基格氏試劑反應就可以製得相應的苯基格氏試劑。
3、格氏試劑去質子化:比如用乙基格氏試劑和乙炔反應製得乙炔格氏試劑。這種製備方法用的相對較少。
4、有些難以製備的格氏試劑還可以通過有機鋰試劑和氯化鎂或者溴化鎂發生金屬交換製備。
格氏試劑的形成機理尚不清楚,目前大多數認為是自由基的過程。在溶液中也不是簡單的RMgX,而是幾種形式平衡共存,稱之為Schlenk平衡。
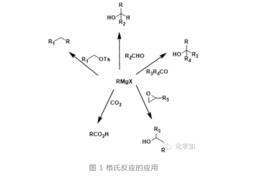
格氏試劑的套用舉例
格氏試劑和醛酮反應生成醇,在格氏反應中,有時候也會加入CeCl,Ti(OiPr)等作為Lewis酸去活化醛酮等親電試劑,從而有助於格氏反應的進行。格氏試劑與環氧反應生成延長兩個碳單位的醇,和酯、醯氯、酸酐等反應第一步生成酮,但往往不能停留在酮,酮馬上會和格氏試劑繼續反應生成醇。
格氏試劑和腈反應則是製備酮的有效方法,和二氧化碳反應形成羧酸,這都是基礎有機化學的內容,想必大家都耳熟能詳,不再贅述。需要指出的是,烯丙型的格氏試劑會和烯、炔發生ene反應得到新的格氏試劑。格氏試劑和不飽和醛酮一般會發生1,2-加成,當有催化量的一價銅時,則會發生1,4-加成。也可以在金屬催化下和鹵代烴發生Kumada偶聯反應,這些都是非常重要的碳碳鍵形成反應,有機合成反應中經常會遇到。
這裡舉兩個複雜天然產物全合成中的例子。2011年,北京大學化學院楊震教授在複雜天然產物五味子降三萜Schindilactone A 的全合成中,總共29步就有4次用到了格氏反應,格氏反應在碳碳鍵形成中的重要性可見一斑。
手性格氏試劑
雖然格氏試劑發展較為成熟,套用比較廣泛,但手性格氏試劑的研究卻很少,這裡主要指的是手性碳直接和鎂相連的格氏試劑,這類試劑具有很強的手性誘導作用,但限制因素也很明顯,一是手性格氏試劑製備困難,二是在高溫等條件下手性格氏試劑很容發生消旋化。常用的方法是低溫下,用手性亞碸和格氏試劑交換來製備。