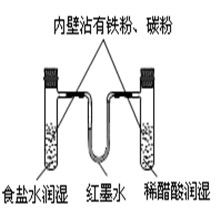
基本知識
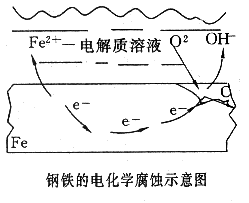 析氫腐蝕
析氫腐蝕⑴pH<3時,陰極反應受活化極化控制。
⑵在弱氧化性和非氧化性酸溶液中,在反應速度不是很大時,陽極反應亦受活化極化控制。
⑶Fe在酸溶液中的腐蝕形態,一般是均勻腐蝕。所以,Fe在酸溶液中的腐蝕可以當作均相腐蝕電極處理,作為活化極化控制腐蝕體系的典型例子。
負極(鐵):鐵被氧化Fe-2e-=Fe2+;
影響條件
a值
 析氫腐蝕
析氫腐蝕按|a|的大小可劃分:
高氫過電位金屬(如Hg,Pb,Zn,Cd)中氫過電位金屬(如Cu,Fe,Ni)低氫過電位金屬可知,a值反映了交換電流密度i0大小。(隨著i0增大,|a|減小)
b值
b稱為Tafel斜率,與金屬材料和溶液關係很小,
故各種金屬表面上析氫反應的b值相差不大。
b=118mV(䲁=51.24mV),這是一個典型的數值。
對單電子反應n=1,取傳遞係數䲁α=0.5,在25℃,可以算出b=118mv。
析氫腐蝕的控制類型
腐蝕特點
可以按照均相腐蝕電極處理,歐姆電阻可以忽略,只需要比較陰極反應和陽極反應的阻力。
屬於活化極化腐蝕體系,陽極反應都受活化極化控制。因此,比較電極反應的阻力,只需比較交換電流密度就行了。
控制類型
陰極極化控制
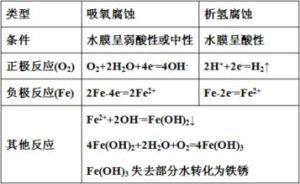 析氫腐蝕
析氫腐蝕其特點是腐蝕電位與陽極反應平衡電位靠近。對這種類型的腐蝕體系,在陰極區析氫反應交換電流密度的大小將對腐蝕速度產生很大影響。
陽極極化控制
只有當金屬在酸溶液中能部分鈍化,造成陽極反應阻力大大增加,才能形成這種控制類型。
有利於陽極鈍化的因素使腐蝕速度減小。
混合控制
陰陽極極化程度差不多,稱為混合控制。
其特點是:腐蝕電位離陽極反應和陰極反應平衡電位都足夠遠。
對於混合控制的腐蝕體系,減小陰極極化或減小陽極極化都會使腐蝕電流密度增大。
影響因素
溶液方面
⑴pH值
溶液pH值對析氫腐蝕速度影響很大,隨pH值下降,腐蝕速度迅速增大。一方面,pH值下降,Eec正移,腐蝕傾向增大;另方面,pH值下降,ic0增大,陰極極化性能減小。
⑵溶液中的其他組分
⑶溫度溫度升高,腐蝕速度迅速增大。
金屬方面
⑴金屬材料種類和雜質
金屬材料種類和所含雜質的影響既涉及陰極反應又涉及陽極反應。混合控制腐蝕體系比陰極極化控制腐蝕體系明顯。
⑵陰極區面積
⑶金屬表面的狀態
腐蝕條件
 析氫腐蝕
析氫腐蝕如果在腐蝕電池中,陽極的電位比氫的平衡電位正,陰極平衡電位當然比氫的平衡電位更正,所以,腐蝕電位比氫的平衡電位正,不能發生析氫腐蝕。
如果陽極電位比氫的平衡電位負時,則腐蝕電位才有可能比氫的平衡電位負,才有可能實現氫去極化和析氫腐蝕。總之,氫的平衡電位成為能否發生析氫腐蝕的重要基準,而EeH=-0.059PH,酸性越強,PH值越小,氫的平衡電位越正和陽極電位越負,對於氫去極化可能性的增加具有等效作用。
因此,許多金屬之所以在中性溶液中不發生析氫腐蝕,就是因為溶液中氫離子濃度太低,氫的平衡電位較低,陽極電位高於氫的平衡電位。但是當選取電位更負的金屬(鎂及合金)作陽極時,因為他們的電位比氫的平衡電位負,有發生析氫腐蝕,甚至在鹼性溶液中也發生極化腐蝕。