化學原理
例如,鋼鐵在接近中性的潮濕的空氣中的腐蝕就屬於吸氧腐蝕。
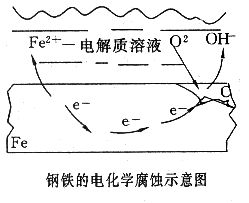
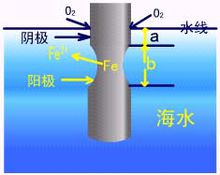
鋼鐵等金屬的電化腐蝕主要是吸氧腐蝕.
吸氧腐蝕的必要條件
 吸氧腐蝕
吸氧腐蝕以氧的還原反應為陰極過程的腐蝕,稱為氧化還原腐蝕或吸氧腐
蝕。發生吸氧腐蝕的必要條件是:金屬的電位比氧化還原反應的電位低。
吸氧腐蝕的陰極去極化劑是溶液中溶解的氧。隨著腐蝕的進行,氧不斷消耗,只有來自空氣中的氧進行補充。因此,氧從空氣中進入溶液並遷移到陰極表面發生還原反應,這一過程包括一系列步驟。
(1) 氧穿過空氣/溶液界面進入溶液;
(2) 在溶液對流作用下,氧遷移到陰極表面附近;
(3) 在擴散層範圍內,氧在濃度梯度作用下擴散到陰極表面;
(4) 在陰極表面氧分子發生還原反應,也叫氧的離子化反應。
控制過程
金屬發生氧去極化腐蝕時,多數情況下陽極過程發生金屬活性溶解,腐蝕過程處於陰極控制之下。氧去極化腐蝕速度主要取決於溶解氧向電極表面的傳遞速度和氧在電極表面上的放電速度。因此,可粗略地將氧去極化腐蝕分為三種情況。
(1)如果腐蝕金屬在溶液中的電位較高,腐蝕過程中氧的傳遞速度又很大,則金屬腐蝕速度主要由氧在電極上的放電速度決定。
(2)如果腐蝕金屬在溶液中的電位非常低,不論氧的傳輸速度大小,陰極過程將由氧去極化和氫離子去極化兩個反應共同組成。
(3)如果腐蝕金屬在溶液中的電位較低,處於活性溶解狀態,而氧的傳輸速度又有限,則金屬腐蝕速度由氧的極限擴散電流密度決定。
擴散控制的腐蝕過程中,由於腐蝕速度只決定於氧的擴散速度,因而在一定範圍內,腐蝕電流將不受陽極極化曲線的斜率和起始電位的影響。
擴散控制的腐蝕過程中,金屬中不同的陰極性雜質或微陰極數量的增加,對腐蝕速度的增加只起很小的作用。
腐蝕過程
隨著鹽濃度的增加,溶液導電性增加,腐蝕速度增加;同時,隨著鹽量增加,氧在溶液中的所謂溶解度降低,從而降低腐蝕速度。鹽量的這種雙重作用導致金屬腐蝕速度在某個鹽濃度時出現極大值在鹽濃度很低時,氧的溶解度比較大,供氧充分,此時隨著鹽濃度增加,由於電導率增加,吸氧腐蝕速度增加。當鹽濃度進一步增加,會使溶解度顯著降低,從而吸氧腐蝕速度也降低。
溶液攪拌和流速的影響
在氧濃度一定的條件按下,極限擴散電流密度與擴散層厚度成反比,溶液流速越大,擴散層厚度越小,氧的極限電流密度也就越大,腐蝕速度越大。
析氫腐蝕與吸氧腐蝕的比較
| 比 較 項 目 | 析氫腐蝕 | 吸氧腐蝕 |
| 去極化劑 性質 | 帶電 氫離子 ,遷移速度和擴散能力都很大 | 中性 氧分子 ,只能靠擴散和對流傳輸 |
| 去極化劑濃度 | 濃度大,酸性溶液中H+ 放電 ,中性 或鹼性溶液中H2O作去極化劑 | 濃度不大,其溶解度通常隨溫度升高和鹽濃度增大而減小 |
| 陰極控制原因 | 主要是 活化極化 :=2.3RT lgiC/i°/αnF | 主要是 濃差極化 :=2.3RT/nFlg(1-iC/iL) |
| 陰極 反應產物 | 以氫氣泡逸出,電極表面溶液得到附加攪拌 | 產物OH只能靠擴散或遷移離開,無氣泡逸出,得不到附加攪拌 |