杜隆-珀替定律
大部分固態單質的比熱容與原子量的乘積幾乎都相等。
別名
比熱容和原子量的乘積就是1摩爾原子的溫度升高1度所需的熱量,習稱為原子熱容,所以這個定律也叫原子熱容定律,即“大多數固態單質的原子熱容幾乎都相等”。
發現者
1819年法國科學家P.-L.杜隆和A.T.珀替,兩位科學家測定了許多單質的比熱容之後,發現這個定律。
定理內容
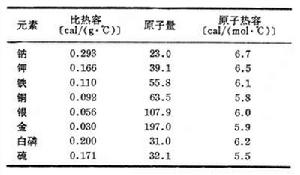
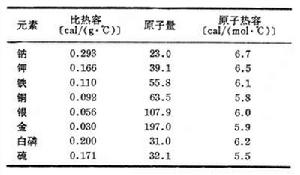
表中列舉一些常見固態單質的有關數據:
 杜隆-珀替定律
杜隆-珀替定律適用條件
在室溫下,這個定律對大多數金屬和一些非金屬是正確的,對有些物質如硼、鈹、金剛石等則在高溫下才比較正確。由表中數據可見,各種單質的比熱容和原子量雖然有很大的差別,但其原子熱容卻幾乎相等,都在6卡/(摩爾·℃)左右。到19世紀中葉人們才逐漸認識到這是由於1摩爾的單質原子中所含原子數目相等,物體溫度升高所需熱量決定於原子的多少而與原子的種類無關。後來又用統計力學能量均分原理對此作了確切的理論推導。定理貢獻
1、在物理學的研究中,杜隆-珀替定律首次揭示了巨觀物理量比熱容與微觀粒子數之間的直接聯繫。
2、杜隆-珀替定律出現在道爾頓原子論問世不久, 原子量數據還處於混亂的年代,杜隆和珀替大膽地按此定律修正了一批元素的原子量。
如當時公認鋅的原子量為129;按原子熱容定律修正為64.5,這和現代精確的原子量65.39很相近。
又如當時公認銀的原子量為379;按原子熱容修正為108,這和現在的銀原子量 107.8682很相近。
對鉛、金、錫、銅、鎳、鐵、硫等元素的原子量,也都有類似的修訂。
此外還有一些元素如鋰、鈉、鉀、鈣、鎂等,它們沒有揮發性的化合物,確定原子量過程中常用的氣體密度法無法採用,所以它們的原子量約值也是由原子熱容定律確定的。
定理歷史地位
這個定律雖然只能確定原子量的約值,但它是與一般化學分析方法迥然不同的物理方法,它為統一原子量提供了獨特的信息。正確的原子量是發現周期律的依據,所以杜隆-珀替定律起過重要的歷史作用。