基本信息
發布日期
1999年3月12日
施行日期
1999年5月1日
內容
第一章 總則
第一條 根據《中華人民共和國藥品管理法》、《中華人民共和國藥品管理法實施辦法》的規定,為規範新藥的研製,加強新藥的審批管理,特制定本辦法。
第二條 新藥系指我國未生產過的藥品。已生產的藥品改變劑型、改變給藥途增加新的適應症或製成新的複方製劑,按新藥管理。
第三條 國家藥品監督管理局主管全國新藥審批工作。新藥經國家監督管理局批准後方可進行臨床研究或生產上市。
第四條 凡在中華人民共和國境內進行新藥研究、生產、經營、使用、檢驗、監督及審批管理的單位或個人,都必須遵守本辦法。
第五條 國家鼓勵研究創製新藥。
第二章 新藥的分類
第六條 新藥按審批管理的要求分以下幾類:
一、 中藥
第一類:
1. 中藥材的人工製成品。
2. 新發現的中藥材及其製劑。
3. 中藥材中提取的有效成分及其製劑。
4. 複方中提取的有效成分。
第二類:
1. 中藥注射劑。
2. 中藥材新的藥用部位及其製劑。
3. 中藥材、天然藥物中提取的有效部位及其製劑。
4. 中藥材以人工方法在動物體內的製取物及其製劑。
5. 複方中提取的有效部位群。
第三類:
1. 新的中藥複方製劑。
2. 以中藥療效為主的中藥和化學藥品的複方製劑。
3. 從國外引種或引進養殖的習用進口藥材及其製劑。
第四類:
1. 改變劑型或改變給藥途徑的製劑。
2. 國內異地引種或野生變家養的動植物藥材。
第五類:
增加新主治病症的藥品。
二、 化學藥品
第一類:首創的原料藥及其製劑。
1. 通過合成或半合成的方法製成的原料藥及其製劑。
2. 天然物質中提取的或通過發酵提取的有效單體及其製劑。
3. 國外已有藥用研究報導,尚未獲一國藥品管理當局批准上市的化合物。
第二類:
1. 已在國外獲準生產上市,但未載入藥典,我國也未進口的藥品。
2. 用拆分、合成的方法首次製得的某一已知藥物中的光學異構體及其製劑。
3. 國外尚未上市的由口服、外用或其它途徑改變為注射途徑給藥者,或由局部
用藥改為全身給藥者(如口服、吸入等製劑)。
第三類:
1. 由化學藥品新組成的複方製劑。
2. 由化學藥品與中藥新組成的複方製劑並以化學藥品發揮主要作用者。
3. 由已上市的多組分藥物製備為較少組分的原料藥及其製劑。
4. 由動物或其組織、器官提取的新的多組分生化藥品。
第四類:
1. 國外藥典收載的原料藥及製劑。
2. 我國已進口的原料藥和/或製劑(已有進口原料製成的製劑,如國內研製其原料及製劑,亦在此列)。
3. 用拆分或合成方法製得的某一已知藥物中國外已獲準上市的光學異構體及製劑。
4. 改變已知鹽類藥物的酸根、鹼基(或金屬元素)製成的原料藥及其製劑。此種改變應不改變其藥理作用,僅改變其理化性質(如溶解度、穩定性等),以適應貯存、製劑製造或臨床用藥的需要。
5. 國外已上市的複方製劑及改變劑型的藥品。
6. 用進口原料藥製成的製劑。
7. 改變劑型的藥品。
8. 改變給藥途徑的藥品(不包括第二類新藥之3)。
第五類:已上市藥品增加新的適應症者。
1. 需延長用藥周期和/或增加劑量者。
2. 未改變或減少用藥用期和/或降低劑量者。
3. 國外已獲準此適應症者。
三、 生物製品
新生物製品的審批按《新生物製品審批辦法》實施。
第七條 在新藥審批過程中,新藥的類別由於在國外獲準上市、載入國外藥典或在我國獲準進口註冊等原因而發生變化,如國家藥品監督管理局業已受理該藥之申請,則維持原受理類別,但申報資料的要求按照變化後的情況辦理,不同單位審批同一品種應維持同一類別。
第三章 新藥的臨床前研究
第八條 新藥臨床前研究的內容包括製備工藝(中藥製劑包括原工藥材的來源、加工及炮製)、理化性質、純度、檢驗方法、處方篩選、劑型、穩定性、質量標準、藥理、毒理、動物藥代動力學等研究。新發現中藥材還應包括來源、生態環境、栽培(養殖)技術、採收處理、加工炮製等研究。
第九條 凡研製麻醉藥品、精神藥品、戒毒藥品、放射性藥品,均應向當地省級藥品監督管理部門提出申請,並報國家藥品監督管理局批准立項後方可實施。
第十條 從事新藥安全性研究的實驗室應符合國家藥品監督管理局《藥品非臨床研究質量管理規範》(GLP)的相應要求,實驗動物應符合國家藥品監督管理局的有關要求,以保證各項實驗的科學性和實驗結果的可靠性。
第四章 新藥的臨床研究
第十一條 新藥的臨床研究包括臨床試驗和生物等效性試驗。
第十二條 新藥的臨床試驗分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
Ⅰ期臨床試驗:初步的臨床藥理學及人體安全性評價試驗。觀察人體對於新藥的耐受程度和藥物代謝動力學,為制定給藥方案提供依據。
Ⅱ期臨床試驗:隨機盲法對照臨床試驗。對新藥有效性及安全性作出初步評價,推薦臨床給藥劑量。
Ⅲ期臨床試驗:擴大的多中心臨床試驗。應遵循隨機對照原則,進一步評價有效性、安全性。
Ⅳ期臨床試驗:新藥上市後監測。在廣泛使用條件下考察療效和不良應(注意罕見不良應)。
第十三條 新藥臨床研究的病例數應符合統計學要求。各類新藥視類別不同進行Ⅰ、Ⅱ、Ⅲ、Ⅳ期臨床試驗。某些類別的新藥可僅進行生物等效性試驗。具體要求見附屬檔案一、二。
第十四條 研製單位和臨床研究單位進行新藥臨床研究,均須符合國家藥品監督管理局《藥品臨床試驗管理規範》(GCP)的有關規定。
第十五條 研製單位在報送申報資料的同時,須在國家藥品監督管理局確定的藥品臨床研究基地中選擇臨床研究負責和承擔單位(Ⅳ期臨床除外),並經國家藥品監督管理局核准。如需增加承擔單位或因特殊需要在藥品臨床研究基地以外的醫療機構進行臨床研究,須按程式另行申請並獲得批准。
第十六條 新藥臨床研究的申請批准後,研製單位要與被確定的臨床研究單位簽訂臨床研究契約,免費提供Ⅰ、Ⅱ、Ⅲ期臨床試驗藥品,包括對照用藥品,承擔臨床研究所需費用。
第十七條 被確定的臨床研究單位應了解和熟悉試驗用藥的性質、作用、療效和安全性,與研製單位按GCP要求一同簽署臨床研究方案,並嚴格按照臨床研究方案進行。
第十八條 新藥研製單位應指定具有一定專業知識的人員遵循GCP的有關要求,監督臨床研究的進行,以求保證按照方案執行。省級藥品監督管理部門按國家藥品監督管理局的要求負責對臨床研究進行監督檢查。
第十九條 臨床研究期間若發生嚴重不良事件,承擔臨床研究的單位須立即採取必要措施保護受試者安全,並在24小時內向當地省級藥品監督管理部門和國家藥品監督管理局報告。
第二十條 臨床研究完成後,臨床研究單位須寫出總結報告,由負責單位匯總,交研製單位。
第五章 新藥的申報與審批
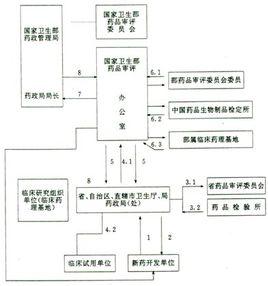
第二十一條 新藥的申報與審批分為臨床研究和生產上市兩個階段。初審由省級藥品監督管理部門負責,複審由國家藥品監督管理局負責。
第二十二條 申請進行新藥臨床研究或生產上市,需報送有關資料(見附屬檔案一、二),提供樣品並填寫申請表(見附表三、四),經省級藥品監督管理部門初審後,報國家藥品監督管理局審批。
第二十三條 省級藥品監督管理部門受理新藥申報後,應對申報的原始資料進行初審,同時派員對試製條件進行實地考察,填寫現場考察報告表(見附表八),並連同初審意見一併上報。
第二十四條 省級藥品檢驗所負責對本轄區內申報新藥的質量標準(草案)進行技術覆核修訂,並對新藥樣品進行檢驗。
第二十五條 國家藥品監督管理局可根據審評的需要安排中國藥品生物製品檢定所進行實驗室技術覆核。
第二十六條 凡屬下列新藥,可按加速程式審評。研製單位可直接向國家藥品監督管理局提出申請,同時報請當地省級藥品監督管理部門進行試製場地考察和原始資料的審核。省級藥品監督管理部門填寫現場考察報告後,上報國家藥品監督管理局。樣品檢驗和質量標準覆核由中國藥品生物製品檢定所負責。
一、 第一類化學藥品。
二、 第一類中藥新藥。
三、 根據國家保密法已確定密級的中藥改變劑型,或增加新的適應症的品種。
第二十七條 屬國內首家申報臨床研究的新藥、國內首家申報的對疑難危重疾病(如愛滋病、腫瘤、罕見病等)有治療作用的新藥,以及製備工藝確有獨特之處的中藥,應加快審評進度,及時審理。
第二十八條 第一類新藥在國家藥品監督管理局批准生產後即予公告,其它各類新藥臨床研究的
申請批准後,亦由國家藥品監督管理局公告。各省級藥品監督管理部門自公告之日起即應停止對同一品種臨床申請的受理,此前已經受理的品種可能繼續審評,但省級藥品監督管理部門應在5個工作日內將已受理品種的全部申報資料報國家藥品監督管理局備案。國家藥品監督管理局對備案資料進行形式審查,申報資料不符合要求的,通知省級藥品監督管理部門退審。
用進口原料藥研製申報製劑的新藥,在批准臨床研究和生產後,如國內有研製同一原料及其製劑的,仍可按規定程式受理申報。經國家藥品監督管理局批准的新藥臨床研究必須在一年內開始實施,否則該項臨床研究需重新申報。
第二十九條 研究單位與生產單位聯合研製的新藥,應向生產單位所在地省級藥品監督管理部門申報。兩家以上的生產單位聯合研製的新藥,應向製劑生產單位所在地省級藥品監督管理部門申報。其它研製單位應同時報請其所在地省級藥品監督管理部門進行試製場地考察和原始資料的審核。所在地省級藥品監督管理部門填寫現場考察報告表,轉到該品種的初審單位。
第三十條 對被駁回的新藥品種有異議的,研製單位可向國家藥品監督管理申請複審。
第三十一條 新藥一般在完成Ⅲ期臨床試驗後經國家藥品監督管理局批准,即發給新藥證書。持有《藥品生產企業許可證》並符合國家藥品監督管理局《藥品生產質量管理規範。(GCP)相關要求的企業或車間可同時發給批准文號,取得批准文號的單位方可生產新藥。
第三十二條 國家對新藥實行保護制度。擁有新藥證書的單位在保護期內可申請新藥證書副本進行技術轉讓。新藥保護及技術轉讓的規定另行制定。
第三十三條 新藥研究單位在取得新藥證書後,兩年內無特殊理由既不生產亦不轉讓者,終止對該新藥的保護。
第三十四條 多個單位聯合研製新藥須聯合申報,經批准後可發給聯合署名的新藥證書,但每個品種(原料藥或製劑)只能由一個單位生產。同一品種的不同規格視為一個品種。
第三十五條 第一類化學藥品及第一、二類中藥批准後一律為試生產。試生產期為二年。其它各類新藥一般批准為正式生產。批准為試生產的新藥,僅供醫療單位在醫生指導下使用,不得在零售藥店出售,亦不得以任何形式進行廣告宣傳。
第三十六條 新藥在試生產期內應繼續考察藥品質量、穩定性及臨床療效和不良反應(應完成符合要求的Ⅳ期臨床的階段性試驗)。藥品檢驗機構要定期抽驗檢查,發現質量問題要及時報告。如發生嚴重不良反應或療效不確定者,國家藥品監督管理局可責令停止生產、銷售和使用。
第三十七條 新藥試生產期滿,生產單位提前3個月提出轉為正式生產申請,報送有關資料(見附屬檔案五),經所在地省級藥品監督管理部門初審後,報國家藥品監督管理局審批。審批期間,其試生產批准文號仍然有效。逾期未提出轉正式生產申請,或經審查不符合規定者,國家藥品監督管理局取消其試生產批准文號。
第三十八條 新藥試生產批准文號為"國藥試字X(或Z)××××××××"。試生產轉為正式生產後,發給正式生產批准文號,格式為"國家準字X(或Z)其中X代表化學藥品,Z代表中藥;字母后的前4位數字為公元年號。
第六章 新藥的質量標準
第三十九條 新藥經批准後,其質量標準為試行標準。批准為試生產的新藥,其標準試行期為三年,其它新藥的標準試行期為兩年。
第四十條 新藥的試行質量標準期滿,生產單位必須提前3個月提出轉正申請,填寫"新藥試行標準轉正申請表"並附有關資料(見附屬檔案六),經省級藥品監督管理部門審查同意,報國家藥品監督管理局審核批准。
第四十一條 新藥質量標準轉正技術審查工作由國家藥典委員會負責,實驗室技術覆核由省級藥品檢驗所負責。兩家以上生產須統一質量標準的同一品種以及第二十六條所列新藥,須經中國藥品生物製品檢定所進行實驗室技術覆核。
第四十二條 同一品種如有不同單位申報,存在不同的試行標準,應按照先進合理的原則進行統一,並須進行實驗覆核。對標準試行截止期先後不同的同一品種,以最先到期的開始辦理轉正。試行期未滿的品種,由國家藥典委員會通知有關單位提前向當地省級藥品監督管理部門辦理轉正手續,以便統一標準。
第四十三條 新藥試行標準轉正時所採用的凡例和附錄等,按照我國現行版藥典的規定執行。
第四十四條 在新藥標準試行期內,藥品生產單位應做好產品的質量考核和標準的修訂工作。標準試行期滿未提出轉正申請,試行標準自行廢止,國家藥品監督管理局同時取消其批准文號。
第四十五條 新藥所需標準品、對照品、由生產單位在申請生產時提供原料或中藥對照品原料及有關技術資料,經中國藥品生物製品檢定所標定後統一分發,並保證其供應。
第七章 新藥的補充申請
第四十六條 已經批准生產的新藥,在保護期內,原生產單位增加規格、改進生產工藝、修改質量標準、改變包裝、修改有效期、在原批准適應症的範圍內修改使用說明書、進口原料藥變更產地等,應提出補充申請。
第四十七條 提出補充申請的單位必須根據補充申請的不同內容報送必要的資料(見附屬檔案七),經省級藥品監督管理部門初審後,報國家藥品監督管理局審批。
第八章 附則
第四十八條 凡從事新藥的研究、生產、經營、使用、檢驗、監督及審批等單位或個人違反本辦法有關規定者,按《中華人民共和國藥品管理法》及有關法律、法規處理。
第四十九條 承擔新藥研究具體工作的單位,應具備相應的專業技術人員,配備必要的研究設施和檢驗儀器,並按照國家藥品監督管理局《藥品研究機構登記備案管理辦法》登記備案。藥品監督部門應加強監督和管理。
第五十條 新藥研究的原始試驗資料及其檔案必須真實、完整、規範。必要時,國家藥品監督管理局可調閱核查。第五十一條 新藥的命名應符合國家藥品監督管理局頒布的藥品命名原則。
第五十二條 國外廠商在中國申報生產新藥,必須由其在中國登記註冊的合法藥品生產企業按本辦法辦理;如僅申請臨床研究的新藥,按《國外藥品在中國進行臨床研究的規定》辦理。對所申報資料的檢查及現場考察事宜由國家藥品監督管理局負責。
第五十三條 在新藥審查過程中,發現報送虛假資料或樣品,或無法證實所報送資料及樣品真實性者,應終止審查,並按照國家藥品監督管理局《藥品轉讓多家研製單位成為新藥申報資料者,轉正方與受讓方均按提供虛假資料論處。
第五十四條 研製單位在申請新藥臨床研究、生產、或試行標準轉正時,應按規定交納審批費、技術覆核和樣品檢驗費。
第五十五條 申請新生物製品按<<新生物製品審批辦法>>辦理。
第五十六條 本辦法由國家藥品監督管理負責解釋。
第五十七條 本辦法自1999年5月1日起施。