概況
腫瘤分子靶向治療取得新進展
中國第一個人源化單抗藥物泰欣生療效顯著
相當長的一段時間,中國的靶向藥物市場主要被外國進口藥物所壟斷,2008年,我國第一個用於治療惡性腫瘤的功能性單抗藥物泰欣生(尼妥珠單抗)獲準上市,首次打破了國外壟斷。
EGFR在多種實體瘤中過度表達,如頭頸癌、肺癌、結直腸癌中,都存在EGFR過度表達現象。EGFR的過度表達與腫瘤的高侵襲力、高轉移性及不良預後高度相關。泰欣生(尼妥珠單抗,Nimotuzumab),是全球第一個以表皮生長因子受體(EGFR)為靶點的單抗藥物,中國第一個治療惡性腫瘤的人源化單克隆抗體。泰欣生能夠競爭性結合EGFR,阻斷由EGFR與其介導的下游信號轉導通路,從而抑制腫瘤細胞增殖、誘導分化、促進細胞凋亡、抑制腫瘤血管生成、增強放化療療效。
目前,泰欣生已在中國、美國、德國、加拿大、日本、古巴、印度等20個國家進行多項臨床研究,正在開展或已經完成的臨床試驗約100餘項,已入組患者近5000例,包括泰欣生聯合放療、化療治療鼻咽癌、頭頸部腫瘤、神經膠質瘤、結直腸癌、胰腺癌、食管癌、肝癌、非小細胞肺癌等實體瘤。臨床研究證實,患者疾病控制率高,生存獲益顯著,不良反應輕微,具有很高的臨床套用價值。
適應症
試用於與放療聯合治療表皮生長因子受體 (EGFR) 表達陽性的III/IV期鼻咽癌。
規格
50mg/瓶 (10mL)。
用法用量
將兩瓶 (100mg) 尼妥珠單抗注射液稀釋到250mL生理鹽水中,靜脈輸液給藥,給藥過程應持續60分鐘以上。在給藥過程中及給藥結束後1小時內,需密切監測患者的狀況。首次給藥應在放射治療的第一天,並在放射治療開始前完成。之後每周給藥1次,共8周,患者同時接受標準的放射治療 。
不良反應
在中國進行的晚期鼻咽癌II期臨床試驗中,共有137例晚期鼻咽癌患者入組,試驗組70例用藥,尼妥珠單抗注射液每周給藥1次,每次100mg,共8周。與本品相關的不良反應主要表現為輕度發熱、血壓下降、噁心、頭暈、皮疹,見表1:
 尼妥珠單抗
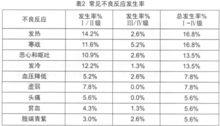
尼妥珠單抗在古巴、德國、加拿大等國家進行了本品單藥或聯合放化療治療頭頸部腫瘤、神經膠質瘤、胰腺癌、結直腸癌和非小細胞肺癌的臨床試驗。尼妥珠單抗的劑量範圍為100-400mg/次,用藥1-6次,其中86.5%的患者用藥6次,每周1次。患者平均年齡55歲(20-75歲),男性57例,女性32例,共89例。與藥物相關的常見和罕見不良反應詳見表2和表3,其中I、II級不良反應占多數,均可自行緩解或使用常規劑量的鎮痛藥和/或抗組胺藥對症治療,未見皮疹和其它皮膚毒性的報告 。
 尼妥珠單抗
尼妥珠單抗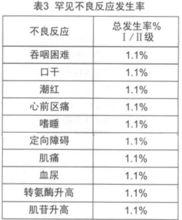 尼妥珠單抗
尼妥珠單抗禁忌
對本品或其任一組份過敏者禁用。
注意事項:
1.本品應在具有同類藥品使用經驗的臨床醫師指導下使用,並具備相應搶救措施。
2.凍融後抗體的大部分活性喪失,故本品在儲存和運輸過程中嚴禁冷凍。本品稀釋於生理鹽水後,在2℃-8℃可保持穩定12小時,在室溫下可保持穩定8小時。如稀釋後儲存超過上述時間,不宜使用。
3.應由熟練掌握EGFR檢測技術的專職人員進行EGFR表達水平的檢驗。檢驗中若出現組織樣本質量較差、操作不規範、對照使用不當等情況,均可導致結果偏差 。
孕婦及哺乳期婦女用藥
本品可透過胎盤屏障,研究提示EGFR與胎兒組織分化、器官形成有關,故孕婦或沒有採取有效避孕措施的婦女應慎用。本品屬於lgG1類抗體,由於人lgG1能夠分泌至乳汁,建議哺乳期婦女在本品治療期間以及在最後一次給藥後60天內停止哺乳 。
兒童用藥
尚未確定18歲以下兒童使用本品的安全性和療效 。
老年用藥
在70例接受尼妥珠單抗注射液聯合放射治療的患者中,4例(5.7%)年齡在65歲或以上。尚未確定老年患者使用本品安全性和療效方面的特殊性 。
藥物相互作用
尚缺乏本品與其它藥物相互作用的數據 。
藥物過量
在每人每次200mg-400mg劑量下可以耐受,目前尚未獲得使用超過400mg劑量時的安全性數據 。
藥理毒理
藥理作用
EGFR是一種跨膜糖蛋白,分子量為170KD,其胞內區具有特殊的酪氨酸激酶活性。體內和體外研究顯示,尼妥珠單抗可阻斷EGFR與其配體的結合,並對EGFR過度表達的腫瘤具有抗血管生成、抗細胞增殖和促凋亡作用 。
毒理研究
對小鼠和綠猴進行尼妥珠單抗的單次給藥急性毒性試驗,劑量分別為1.42mg/kg、7.14mg/kg、28.57mg/kg、57mg/kg,相當於人用劑量的0.85倍至34倍,未見毒性反應,單劑量重複給藥試驗未見毒性跡象。綠猴體內6個月的長期毒性試驗,劑量分別為3.3mg/kg和33mg/kg,相當於人用劑量的2倍和20倍,血生化、心電圖、體重、各器官病理組織血檢查均未見異常,未見長期靜脈注射所導致的動物皮膚損害 。
對小鼠和家兔進行的局部耐受性試驗,注射局部未見靜脈刺激反應。用成人不同組織的冰凍切片進行交叉反應試驗,顯示尼妥珠單抗和人體組織 (如心臟、血管、腎臟和肺) 無交叉反應。尚未進行致癌、致突變和生殖損害的特殊毒性研究 。
藥代動力學
以下數據來自國外研究。
對12例古巴晚期惡性腫瘤患者進行了藥代動力學觀察,其中女性11例,男性1例,平均年齡59.33歲,卵巢癌患者4例、乳腺癌患者4例、肺癌患者2例、胃癌患者1例、腎癌患者1例,靜脈注射50mg、100mg、200mg和400mg尼妥珠單抗,其對應的清除半衰期分別為62.92、82.60、302.95和304.52小時。
用藥後24小時內,不同劑量尼妥珠單抗經厲排出量占注射劑量(ID)的比例分別為:50mg排出21.08%,100mg排出28.20%,200mg排出27.36%,400mg排出33.57%。
本品在人體內生物學分布的主要器官為肝臟、脾臟、心臟、腎臟和膽囊,其中肝臟攝取量最高。
動物藥代動力學數據證實給藥後24小時腫瘤組織藥物濃度最高。
尚缺乏本品在中國人群中進行藥代動力學的研究數據 。
套用價值
1 、泰欣生治療頭頸部腫瘤
一項泰欣生聯合放療治療晚期頭頸部腫瘤的臨床研究顯示,患者3年生存率高達66.7%,而單純放療的3年生存率僅為40%左右,泰欣生顯著提高了放療的療效。一項泰欣生治療晚期鼻咽癌(頭頸部腫瘤的一種)臨床研究,泰欣生聯合放療有效率為100%,腫瘤完全緩解率為90.63%。3年生存期隨訪結果顯示,與單純放療相比,泰欣生聯合放療組3年生存率為84.29%,較之對照組提高了近10個百分點,顯著延長了患者的生存時間。
不久前在美國放射腫瘤年會(ASTRO)上發布了一組令人振奮的研究數據,泰欣生聯契約步放化療的有效率達100%,完全緩解率為90%。國際上對於癌症“治癒”的概念,是指患者無病生存5年以上為治癒。泰欣生治療頭頸部腫瘤、鼻咽癌高達90%的腫瘤完全緩解率,堅定了患者獲得痊癒的信念。該項臨床研究另一組分析表明,泰欣生聯合放療與標準的同步放化療療效相當,這為不能耐受強烈化療的晚期頭頸部腫瘤患者提供了一個新的解決方案,可以免受化療之苦 。
2 、泰欣生治療惡性神經膠質瘤
在第44屆美國臨床腫瘤學會年會(ASCO 2008)上,泰欣生聯合放療顯著延長彌散性內源性腦橋膠質瘤兒童及青少年生存期的Ⅲ期臨床研究報告,引起了與會專家的廣為關注。這是一項在德國、俄羅斯、義大利多個國家開展的臨床研究,入組患者均為新診斷的患者。研究結果顯示:共有41例患者可評估,其中,4例(9.8%)患者部分緩解(PR),27例(65.8%)患者疾病穩定(SD),中位疾病控制時間(DDC)為195天(28-645天)。中位無疾病進展時間(PFS)為177天,中位生存時間為292天。患兒耐受性良好,沒有患者因無法耐受而退出研究。較之強烈的化療方案,泰欣生聯合放療,患兒疾病控制時間延長,生活質量高 。
2008年底召開的美國癌症研究學會年會(AACR 2008)公布了一項泰欣生聯合放療治療惡性神經膠質瘤的隨機、對照、雙盲、多中心臨床研究,80例患有惡性神經膠質瘤的患者隨機分組,試驗組接受放療聯合尼妥珠單抗治療,對照組接受放療聯合安慰劑治療。研究結果顯示:試驗組中位生存期為16.43個月,對照組為10.49個月,患者生存期獲益顯著。
由於泰欣生在晚期惡性神經膠質瘤治療取得的突出成就,2004年,該藥通過了美國FDA及歐盟藥監局EMEA的雙重認證,獲批晚期神經膠質瘤孤兒藥資格。該藥有望獲批作為兒科治療晚期惡性神經膠質瘤膠質瘤的一線治療藥物。
3 、泰欣生治療消化系腫瘤
在剛剛結束的2009年ASCO GI(美國臨床腫瘤學大會胃腸道腫瘤)會議上,公布了泰欣生聯合伊立替康用於經伊立替康治療失敗後轉移性結直腸癌患者的II期臨床研究最新中期結果。該研究所有入組患者均接受過標準的治療(排除受過EGFR單抗治療),經伊立替康化療後疾病出現進展。入組患者中100%既往接受過伊立替康的治療,89%接受過奧沙利鉑的治療,45%接受過VEGF單抗的治療。治療方案為:尼妥珠單抗400mg,靜脈滴注,每周一次;伊立替康延續入組前的治療劑量;治療持續至患者疾病進展。
臨床研究數據顯示:共有58例可評估患者入組。其中有2例(3.4%)部分緩解(PR),27例(46.4%)疾病穩定(SD)。PFS為12周,OS為9.3個月。毒性反應極輕。沒有出現輸液反應。只有15例患者(26%)出現I、II級皮疹。2例出現I級低鎂血症。沒有患者因為不良事件中止治療。其中對17例患者的組織標本進行KRAS檢測,大約30%出現KRAS突變。KRAS突變型的PFS為12周,而野生型的PFS為18周。
該研究中期結果顯示:尼妥珠單抗聯合伊立替康,能夠逆轉伊立替康的耐藥。與其它EGFR單抗相比,泰欣生聯合伊立替康,疾病控制率(PR+CR+SD)達到50%,OS也基本接近西妥昔單抗聯合伊立替康既往報導的數據。尼妥珠單抗與EGFR的親和力和其它EGFR單抗有所不同,它與EGFR為雙價結合,而其他單抗為單價、雙價同時結合。這意味著尼妥珠單抗可能對EGFR中高度表達更有效,同時由於與正常組織結合不穩定,其毒副反應發生率較低。
在歐洲,正在進行泰欣生聯合吉西他濱治療晚期難以控制的胰腺癌臨床試驗,結果顯示:該藥使患有晚期難以控制腫瘤的患者臨床獲益顯著。由於泰欣生在晚期胰腺癌治療療效頗令人鼓舞,2008年4月,歐盟藥監局(EMEA)批准該藥作為胰腺癌孤兒藥資格,準予進行臨床 。
4 、藥物選擇性高,安全性好
泰欣生有一個非常突出的特點,就是選擇性高,安全性好。痤瘡樣皮疹的發生,多數是由於靶向藥物選擇性差造成的。藥物敵我不分,在阻斷腫瘤組織EGFR信號通路的同時,又干擾了正常組織的信號通路,患者常因嚴重的皮膚毒性反應而不得不減量或停藥。泰欣生選擇性強表現在只針對腫瘤組織,而不傷害正常組織,在取得突出療效的同時,幾乎不存在痤瘡樣皮疹反應。
泰欣生還有一個突出特點就是安全性好。泰欣生是人源化單抗藥物,人源化單抗藥物是比嵌合單抗更新一代的靶向藥物。泰欣生人的成分高達95%,臨床套用過程中至今未見超敏反應的發生,用藥前不必進行抗過敏治療的預處理,更安全、更方便。
生存期獲益顯著,生活質量大大提高,泰欣生臨床效果頗令人鼓舞,目前該藥在滿足國內市場的需求的同時,已經大批量出口。2009年,泰欣生正駛入高速發展快車道。2008年8月,國家食品藥品監督管理局(SFDA)批准泰欣生進行新適應症臨床研究,包括泰欣生治療神經膠質瘤、結直腸癌、肺癌、食管癌。這些臨床研究正在陸續啟動。目前,正在開展泰欣生聯契約步放化療治療晚期鼻咽癌的III期大規模註冊性臨床研究。
腫瘤臨床專家一致認為:隨著更多臨床研究開展,更多循證醫學證據支持,泰欣生必將為更多腫瘤患者帶來康復的希望 。

