成份
每瓶含50mg尼妥珠單抗、4.5mg磷酸二氫鈉、18.0mg磷酸氫二鈉、86.0mg氯化鈉、2.0mg聚山梨醇酯80。
性狀
本品為無色澄明液體。
適應症
試用於與放療聯合治療表皮生長因子受體 (EGFR) 表達陽性的III/IV期鼻咽癌。
規格
50mg/瓶 (10mL)。
用法用量
將兩瓶 (100mg) 尼妥珠單抗注射液稀釋到250mL生理鹽水中,靜脈輸液給藥,給藥過程應持續60分鐘以上。在給藥過程中及給藥結束後1小時內,需密切監測患者的狀況。首次給藥應在放射治療的第一天,並在放射治療開始前完成。之後每周給藥1次,共8周,患者同時接受標準的放射治療。
不良反應
 泰欣生
泰欣生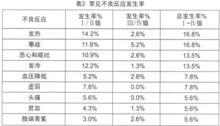 泰欣生
泰欣生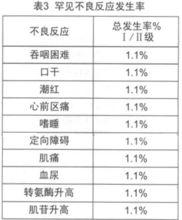 泰欣生
泰欣生在中國進行的晚期鼻咽癌II期臨床試驗中,共有137例晚期鼻咽癌患者入組,試驗組70例用藥,尼妥珠單抗注射液每周給藥1次,每次100mg,共8周。與本品相關的不良反應主要表現為輕度發熱、血壓下降、噁心、頭暈、皮疹,見表1:
在古巴、德國、加拿大等國家進行了本品單藥或聯合放化療治療頭頸部腫瘤、神經膠質瘤、胰腺癌、結直腸癌和非小細胞肺癌的臨床試驗。尼妥珠單抗的劑量範圍為100-400mg/次,用藥1-6次,其中86.5%的患者用藥6次,每周1次。患者平均年齡55歲(20-75歲),男性57例,女性32例,共89例。與藥物相關的常見和罕見不良反應詳見表2和表3,其中I、II級不良反應占多數,均可自行緩解或使用常規劑量的鎮痛藥和/或抗組胺藥對症治療,未見皮疹和其它皮膚毒性的報告。
禁忌
對本品或其任一組份過敏者禁用。
注意事項
1.本品應在具有同類藥品使用經驗的臨床醫師指導下使用,並具備相應搶救措施。
2.凍融後抗體的大部分活性喪失,故本品在儲存和運輸過程中嚴禁冷凍。本品稀釋於生理鹽水後,在2℃-8℃可保持穩定12小時,在室溫下可保持穩定8小時。如稀釋後儲存超過上述時間,不宜使用。
3.應由熟練掌握EGFR檢測技術的專職人員進行EGFR表達水平的檢驗。檢驗中若出現組織樣本質量較差、操作不規範、對照使用不當等情況,均可導致結果偏差。
孕婦及哺乳期婦女用藥
本品可透過胎盤屏障,研究提示EGFR與胎兒組織分化、器官形成有關,故孕婦或沒有採取有效避孕措施的婦女應慎用。本品屬於lgG1類抗體,由於人lgG1能夠分泌至乳汁,建議哺乳期婦女在本品治療期間以及在最後一次給藥後60天內停止哺乳。
兒童用藥
尚未確定18歲以下兒童使用本品的安全性和療效。
老年用藥
在70例接受尼妥珠單抗注射液聯合放射治療的患者中,4例(5.7%)年齡在65歲或以上。尚未確定老年患者使用本品安全性和療效方面的特殊性。
藥物相互作用
尚缺乏本品與其它藥物相互作用的數據。
藥物過量
在每人每次200mg—400mg劑量下可以耐受,目前尚未獲得使用超過400mg劑量時的安全性數據。
藥理毒理
藥理作用:
EGFR是一種跨膜糖蛋白,分子量為170KD,其胞內區具有特殊的酪氨酸激酶活性。體內和體外研究顯示,尼妥珠單抗可阻斷EGFR與其配體的結合,並對EGFR過度表達的腫瘤具有抗血管生成、抗細胞增殖和促凋亡作用。
毒理研究:
對小鼠和綠猴進行尼妥珠單抗的單次給藥急性毒性試驗,劑量分別為1.42mg/kg、7.14mg/kg、28.57mg/kg、57mg/kg,相當於人用劑量的0.85倍至34倍,未見毒性反應,單劑量重複給藥試驗未見毒性跡象。綠猴體內6個月的長期毒性試驗,劑量分別為3.3mg/kg和33mg/kg,相當於人用劑量的2倍和20倍,血生化、心電圖、體重、各器官病理組織血檢查均未見異常,未見長期靜脈注射所導致的動物皮膚損害。
對小鼠和家兔進行的局部耐受性試驗,注射局部未見靜脈刺激反應。用成人不同組織的冰凍切片進行交叉反應試驗,顯示尼妥珠單抗和人體組織 (如心臟、血管、腎臟和肺) 無交叉反應。尚未進行致癌、致突變和生殖損害的特殊毒性研究。
藥代動力學
以下數據來自國外研究。
對12例古巴晚期惡性腫瘤患者進行了藥代動力學觀察,其中女性11例,男性1例,平均年齡59.33歲,卵巢癌患者4例、乳腺癌患者4例、肺癌患者2例、胃癌患者1例、腎癌患者1例,靜脈注射50mg、100mg、200mg和400mg尼妥珠單抗,其對應的清除半衰期分別為62.92、82.60、302.95和304.52小時。
用藥後24小時內,不同劑量尼妥珠單抗經厲排出量占注射劑量(ID)的比例分別為:50mg排出21.08%,100mg排出28.20%,200mg排出27.36%,400mg排出33.57%。
本品在人體內生物學分布的主要器官為肝臟、脾臟、心臟、腎臟和膽囊,其中肝臟攝取量最高。
動物藥代動力學數據證實給藥後24小時腫瘤組織藥物濃度最高。
尚缺乏本品在中國人群中進行藥代動力學的研究數據。
貯藏
本品在2℃-8℃儲存和運輸,不得冷凍。
包裝
硼矽玻璃管制注射劑瓶,1瓶/盒。
有效期
24個月。
執行標準
YBS00012008
批准文號
國藥準字S20080001
生產企業
百泰生物藥業有限公司
核准日期
2008年01月07日
