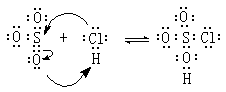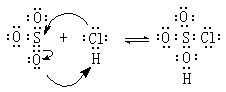兩性化合物
正文
兩性化合物既能與酸又能與鹼作用生成鹽,如:Al2O3+6HCl─→2AlCl3+3H2O
Al2O3+2NaOH+3H2O─→2NaAl(OH)4
Al(OH)3+3HCl─→AlCl3+3H2O
Al(OH)3+NaOH─→NaAl(OH)4
鋅、銅 (Ⅱ)、鉻 (Ⅲ)、鎵的氧化物、氫氧化物等也是兩性化合物。一些元素能生成兩性氧化物和氫氧化物,其特點是:元素氧化數適中,一般為+2~+4,個別是+5;最外層電子數為8~18個,如Zn(OH)2的最外層電子為18個;少數是8電子結構,如Al(OH)3;個別是2電子結構,如Be(OH)2。兩性的非金屬氫氧化物有亞砷酸H3AsO3、亞碲酸H2TeO3及次碘酸HOI。
根據兩性氫氧化物以酸性或鹼性為主,而命名為某酸或氫氧化物。如亞砷酸、氫氧化鋁。金屬的兩性氧化物和氫氧化物都難溶於水。
因酸、鹼定義的不同,兩性化合物所指的化合物範圍不盡相同。①按酸鹼質子理論(見酸鹼理論),水、氨等也是兩性化合物,它們既能釋放質子(酸),又能接受質子(鹼)。
接受質子 H++H2O─→H3O+
H++NH3─→NH4+
釋放質子 H2O+CO娫─→HCO婣+OH-
NH3+H-─→NH娛+H2
按照這個理論,胺基酸也是兩性化合物,如甘氨酸NH2CH2COOH的羧基能釋放質子(酸),氨基能接受質子(鹼)。②按路易斯酸鹼理論,氯化氫和三氧化硫也是兩性化合物: