簡介
 三氧化二磷
三氧化二磷中文名:三氧化二磷拼音:sānyǎnghuàèrlín英文名稱:diphosphorustrioxideP4O6的結構
說明:p2o3或P4O6又名亞磷酐。白色單斜晶體。有蒜臭。有毒!相對密度2.135(21℃)。在23.8℃時熔融為無色透明極易流動的液體。沸點為173℃.溶於乙醚、苯和二硫化碳。在直接日光即迅速氧化。在70℃時可引起燃燒。由磷在有限供給空氣下燃燒而成。
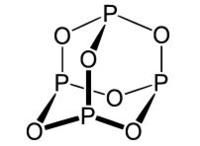
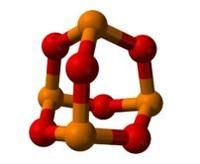
三氧化二磷在氣態或液態都是二聚分子P4O6,其中4個磷原子構成一個四面體,6個氧原子位於四面體每一棱的外側,分別與兩個磷原子形成P-O單鍵,每個磷原子與周圍4個氧原子以O-P鍵連線形成一個四面體.其中3個氧原子是與另外3個四面體共用.P-O鍵長為165pm,鍵角POP為128度,OPO為99度.
可由五氧化二磷於磷在高溫的條件下生成。3P2O5+4P=5P2O3
在冷水中能緩緩溶解形成亞磷酸,方程式為:P4O6+6H2O(冷)==4H3PO3
與熱水發生猛烈作用則歧化為磷酸和膦或者單質磷
方程式為:P4O6+6H2O(熱)==3H3PO4+PH3
或者:5P4O6+18H2O(熱)==12H3PO4+8P
結構
 三氧化二磷
三氧化二磷三氧化二磷(化學式:P4O6)是一種由氧和磷組成的化合物,為無色蠟狀P4O6的結構
有大蒜氣味的極毒晶體,雖然它的正確名稱應該是六氧化四磷,但以前一直以為分子結構是P2O3,因此三氧化二磷的名稱一直沿用至今。三氧化二磷為Td結構,其結構與金剛烷類似,可以看做是金剛烷中的四個叔碳被磷原子替代,而六個仲碳被氧原子替代。三氧化二磷的偶極矩為0.
製備
三氧化二磷由白磷在有限的氧氣中燃燒得到。該反應產率可達50%,產物中含少量白磷,可用汞弧燈照射將白磷轉化為紅磷,然後加熱蒸出三氧化二磷而進行提純(用CS2)。反應的副產物還有五氧化二磷和一氧化四磷。P4+3O2→P4O6用一氧化二氮(N2O)也可以製取P4O6:於823-873K,9.3kPa下使白磷和N2O反應生成P4O6。把O2通入白磷的CCl4溶液,得淺黃色物,後者經真空乾燥得白色P4O6.
物理性質
摩爾質量:109.946g/mol
外觀:無色單斜晶體或液體
密度:2.13g/cm3
熔點:23.8℃
沸點:175.3℃[1](有資料說是173.1℃[2])
pKa:9.2
化學性質
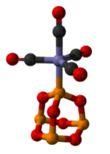 P4O6·Fe(CO)4結構圖
P4O6·Fe(CO)4結構圖200-400°C時在密封管中減壓加熱三氧化二磷時,三氧化二磷分解為四氧化二磷和紅磷:2P4O6→3P2O4+P(紅磷)
三氧化二磷與過量冷水混合振盪反應時生成亞磷酸:P4O6+6H2O→4H3PO3
與熱水的反應複雜且較為劇烈,生成紅磷、磷化氫、亞磷酸和磷酸。
與氯、溴單質反應生成三氯氧磷和三溴氧磷。與碘反應很慢,生成紅色的產物。加壓條件下二者在四氯化碳中反應,析出橘紅色的四碘化二磷:5P4O6+8I2→P2I4+3P4O10
三氧化二磷與氯化氫(Hydrogenchloride)反應生成亞磷酸和三氯化磷:P4O6+6HCl→2H3PO3+2PCl3
P4O6也可以作為配體(性質類似於亞磷酸根),取代四羰基鎳或五羰基鐵中的羰基,形成一系列的配合物。以P4O6·Fe(CO)4為例,該配合物有如圖所示的結構,其中三氧化二磷是用一個磷原子與Fe配位(X射線單晶衍射數據)。高於423K,S可以氧化P4O6:P4O6+4S==P4O6S4
P4O6和B2H6反應生成H3BP4O6BH3:P4O6+B2H6=H3BP4O6BH3P4O6能取代羰基鎳中的羰基,生成P4O6[Ni(CO)3]4、(P4O6)2Ni(CO)2、Ni(CO)(P4O6)3、Fe(CO)4(P4O6)。在最後一個化合物中,P4O6是一個磷原子和鐵原子配位。[3]
