概述
sofosbuvir聯合利巴韋林(ribavirin)用於基因型2和基因型3慢性C型肝炎(hepatitisC)成人患者的治療。同時,sofosbuvir還聯合聚乙二醇干擾素(PEG-IFN)和利巴韋林,用於基因型1和基因型4慢性C型肝炎初治(treat-naive)成人患者的治療。
Sofosbuvir為每日一次的口服核苷類似物聚合酶抑制劑。
Sovaldi的獲批,主要基於4個III期研究(NEUTRINO,FISSION,POSITRON,FUSION)的數據。在FDA審查期間,2個新的III期研究(VALENCE和PHOTON-1)添加至sofosbuvir的新藥申請(NDA),FDA根據這些數據,授予sofosbuvir突破性療法認定。
藥品名稱
 sovaldi
sovaldi通用名:sofosbuvir
中文名:索非布韋
給藥途徑:片劑,為口服使用
批准日期:2013年12月
NDC:61958-1501-1)
公司:吉利德(Gilead)
用藥指導(中國):好醫友(Haoeyou)
適應證和用途
Sovaldi是一種C型肝炎病毒(HCV)核苷酸類似物NS5B聚合酶抑制劑適用為的治療慢性C型肝炎(CHC)感染作為抗病毒聯合治療方案的組分。
● 在有HCV基因1,2,3或4型感染受試者中已確定Sovaldi療效,包括那些有肝細胞癌符合米蘭[Milan]標準(等待肝移植)和有HCV/HIV-1共-感染受試者。
當開始用Sovaldi治療應考慮以下幾點:
●為CHC治療建議不用Sovaldi單藥治療。
●治療方案和時間依賴於病毒基因型和患者群兩方面。
●根據基線宿主和病毒因子治療反應變化。
劑量和給藥方法
成年中推薦劑量
Sovaldi的推薦劑量是400mg片,口服,每天1次有或無食物。
在成年中為CHC的治療Sovaldi應與利巴韋林聯用或與聚乙二醇化干擾素和利巴韋林聯用。表1提供對Sovaldi聯合治療推薦的方案和治療時間。
 表1
表1Sovaldi與利巴韋林聯用共24周對CHC有基因1型感染患者是接受基於干擾素方案不合格可被考慮為一種治療選擇。應通過對個體患者潛在獲益和風險的評估指導治療決策。
有肝細胞癌等待肝移植患者
建議Sovaldi與利巴韋林聯用至48周或直至肝移植的時間,先發生為準,以預防移植後HCV再次感染。
劑量調整
建議不減低Sovaldi劑量。
基因1和4型:如果某個患者有嚴重不良反應潛在地與聚乙二醇干擾素α和/或利巴韋林相關,聚乙二醇干擾素α和/或利巴韋林劑量應被減低或終止。為關於如何減低和/或終止聚乙二醇干擾素α和/或利巴韋林劑量另外信息參閱聚乙二醇干擾素α和利巴韋林處方資料。
基因2和3型:如果某患者有嚴重不良反應潛在地與利巴韋林相關,應修改或終止利巴韋林劑量,如適當,直至不良反應消退或嚴重程度減低。表2提供根據患者的血紅蛋白濃度和心臟狀態對劑量修改和終止指導原則。
 表2
表2給藥的終止
如與Sovaldi的用其他藥物持久終止,OVALDI也應被終止。
嚴重腎受損和腎病終末期
對有嚴重腎受損患者(估計惡腎小球濾過率(eGFR)<30mL/min/1.73m2)或有腎病終末期(ESRD)由於sofosbuvir主要代謝物的高暴露(至20-倍)不能給予劑量建議。
劑型和規格
可得到Sovaldi黃色,膠囊形,薄膜包衣片一側凹陷有“GSI”和另側“7977”。各片含400mgsofosbuvir。
禁忌證
當Sovaldi是與利巴韋林或聚乙二醇干擾素α/利巴韋林聯用,套用至這些藥物的禁忌證也套用至聯合治療。對其禁忌證清單參閱聚乙二醇干擾素α和利巴韋林處方資料。
妊娠或可能成為妊娠婦女和男性其女性伴侶是妊娠禁忌Sovaldi與利巴韋林或聚乙二醇干擾素α/利巴韋林聯合治療因為伴隨用利巴韋林出生缺陷和胎兒死亡。
警告和注意事項
妊娠
使用利巴韋林或聚乙二醇干擾素Α/利巴韋林
利巴韋林可能致出生缺陷和/或被暴露胎兒死亡和動物研究曾顯示t干擾素有流產效應。在婦女患者和男性患者的女性伴侶必須極小心避免妊娠。利巴韋林治療不應開始除非開始治療前立即已得到陰性妊娠測試報告。
當Sovaldi是與利巴韋林或聚乙二醇干擾素α/利巴韋林聯用,有生育能力婦女和其男性伴侶在治療期間和已結束後至少6個月必須使用兩種形式有效避孕。在這個時間必須每月進行常規妊娠測試。沒有婦女服用Sovaldi全身激素避孕藥有效性的數據,因此,治療用Sovaldi和同時利巴韋林期間應使用兩種非激素避孕方法。還參閱對利巴韋林處方資料。
與強P-gp誘導劑使用
藥物是在小腸中強P-gp誘導劑(如,利福平,聖約翰草)可能顯著減低sofosbuvir血漿濃度和可能導致減低Sovaldi治療作用。利福平和聖約翰草不應與Sovaldi使用。
不良反應
臨床試驗
Sovaldi應與利巴韋林或聚乙二醇干擾素α/利巴韋林給藥。伴隨其使用不良反應的描述參閱聚乙二醇干擾素α和利巴韋林處方資料。
因為臨床試驗是在廣泛不同情況下進行的,臨床試驗觀察到不良反應率不能與另一種藥臨床試驗發生率直接比較而且可能不反映實踐中觀察到的發生率。
Sovaldi的安全性評估是根據3期臨床試驗合併數據(對照和非對照兩方面)包括650例受試者接受Sovaldi+利巴韋林(RBV)聯合治療共12周,98例受試者接受Sovaldi+利巴韋林聯合治療共16周,250例受試者接受Sovaldi+利巴韋林聯合治療共24周,327例受試者接受Sovaldi+聚乙二醇干擾素(Peg-IFN)α+利巴韋林聯合治療共12周,243例受試者接受聚乙二醇干擾素α+利巴韋林共24周和71例受試者接受安慰劑(PBO)共12周。
對受試者接受安慰劑由於不良事件永久終止治療受試者的比例為4%,對受試者接受Sovaldi+利巴韋林共12周為1%,對受試者接受Sovaldi+利巴韋林共24周為<1%,對受試者接受聚乙二醇干擾素α+利巴韋林共24周為11%和對受試者接受Sovaldi+聚乙二醇干擾素α+利巴韋林共12周為2%。
表3中提供在臨床試驗中觀察到在≥15%受試者治療-出現不良事件。並排列表是為了簡化展示;直接跨越試驗比較不應是由於不同試驗設計造成。
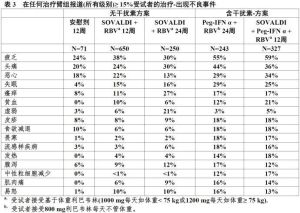 表3
表3對Sovaldi+利巴韋林聯合治療最常見不良事件(≥20%)是疲乏和頭痛。對Sovaldi+聚乙二醇干擾素α+利巴韋林聯合治療最常見不良事件(≥20%)是疲乏,頭痛,噁心,失眠和貧血。
表3除了貧血和中性粒細胞減少,在含Sovaldi-方案展示事件的大多數發生嚴重程度1級。
在臨床試驗中報導的較不常見不良反應(<1%):在任何一項試驗在一個聯合方案接受Sovaldi受試者<1%發生以下ADRs。這些事件曾被包括因為其嚴重性或接受潛在因果相互關係評估。
血液學效應:全血細胞減少(特別是在同時接受聚乙二醇化干擾素受試者)。
精神疾病:嚴重抑鬱(特別是在預先存在精神疾病史受試者中),包括自殺意念和自殺。
實驗室異常
在表4中描述在選定的血液學參數中變化。並排列表是為了簡化展示;跨越試驗直接比較不應由於不同試驗設計所致。
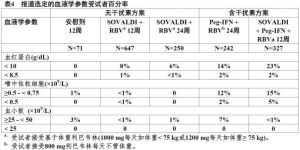 表4
表4膽紅素升高
觀察到在Sovaldi+聚乙二醇干擾素α+利巴韋林12周組沒有受試者總膽紅素升高超過2.5×ULN而在聚乙二醇干擾素α+利巴韋林24周,Sovaldi+利巴韋林12周和Sovaldi+利巴韋林24周組受試者,分別為1%,3%和3%.duringthefirst1to2weeksof治療的第1至2周膽紅素水平達峰值和隨後減低和治療後第4周返回至基線水平。這些膽紅素升高不伴隨轉氨酶升高.
肌酸激酶升高
在FISSION和NEUTRINO試驗中評估肌酸激酶。在聚乙二醇干擾素α+利巴韋林24周,Sovaldi+聚乙二醇干擾素α+利巴韋林12周和Sovaldi+利巴韋林12周組,分別觀察到<1%,1%和2%受試者有孤立的,無症狀肌酸激酶升高大於或等於10×ULN。
脂肪酶升高
在Sovaldi+聚乙二醇干擾素α+利巴韋林12周,Sovaldi+利巴韋林12周,Sovaldi+利巴韋林24周和聚乙二醇干擾素α+利巴韋林24周組,分別觀察到<1%,2%,2%,和2%受試者大於3×ULN孤立的,無症狀脂肪酶升高。
藥物相互作用
對藥物潛在的相互作用
口服Sovaldi後,sofosbuvir被迅速地轉化為主要循環代謝物GS-331007占大於90%藥物相關物質全身暴露,而母體sofosbuvir占藥物相關物質約4%。在臨床藥理學研究,sofosbuvir和GS-331007兩種都為藥代動力學分析目的被檢測。
Sofosbuvir是藥物轉運蛋白P-gp和乳腺癌耐藥蛋白(BCRP)的底物而GS-331007不是。藥物是小腸中強P-gp誘導劑(如,利福平或聖約翰草)可能減低sofosbuvir血漿濃度導致減低Sovaldi治療作用和因此不應與Sovaldi使用。Sovaldi與抑制P-gp和/或BCRP藥物的共同給藥可能增加sofosbuvir的血漿濃度而GS-331007血漿濃度無增加;因此,Sovaldi可能被與P-gp和/或BCRP抑制劑共同給藥。Sofosbuvir和GS-331007不是P-gp和BCRP的抑制劑和因此預計不增加這些轉運蛋白底物藥物的暴露。
Sofosbuvir細胞內代謝性激活通路一般地通過低親和高容量水解酶和核苷酸磷酸化通路很可能不受同時藥物影響。
潛在地顯著藥物相互作用
表5中總結了對Sovaldi與潛在同時藥物藥物相互作用信息。被描述藥物相互作用是根據可能與Sovaldi發生潛在地藥物相互作用。這個表不是全包括。
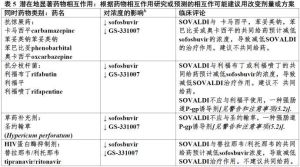 表5
表5與Sovaldi無臨床上顯著相互作用藥物
除了包括在表5藥物外,在臨床試驗中評價了Sovaldi和以下藥物間相互作用和對任一藥物無需調整劑量:環孢黴素,達蘆那韋/利托那韋,依非韋倫,恩曲他濱,美沙酮,拉替拉韋,利匹韋林,他克莫司,或富馬酸替諾福韋酯。.
特殊人群中使用
妊娠
妊娠類別X:使用利巴韋林或聚乙二醇干擾素Α/利巴韋林
女性患者和男性患者的女性伴侶當服用這個組合時必須極度小心避免妊娠。育齡婦女及其男性伴侶不應接受利巴韋林除非他們用利巴韋林治療期間和治療結束後共6個月使用兩種型式有效避孕。在服用Sovaldi婦女中沒有全身激素避孕有效性的數據。因此,用Sovaldi和同時利巴韋林治療期間應使用兩種有效非激素避孕方法。
動物數據
在所有動物種屬暴露於利巴韋林曾證實顯著致畸胎作用和/或殺胚胎作用;和因此妊娠婦女利巴韋林和妊娠婦女男性伴侶禁忌,警告和注意事項(5.1)和利巴韋林包裝外掛程式]。在動物中干擾素有流產效應和應被假設在人中有流產潛能。
妊娠類別B:Sovaldi
在妊娠婦女中沒有用Sovaldi適當和對照良好研究。.
動物數據
在大鼠和兔中在最高測試劑量未觀察到對胎兒發育影響。在大鼠和兔中,AUC暴露至主要循環代謝物GS-331007隨妊娠過程增加分別從人在推薦臨床劑量暴露約5-至10-倍和12-至28-倍。
哺乳母親
不知道Sovaldi及其代謝物是否存在在人乳汁。哺乳大鼠的乳汁中主要循環代謝物GS-331007是觀察到主要組分,對哺乳幼畜無影響。因為哺乳嬰兒來自藥物不良反應潛能,必須做出決策是否終止哺乳或終止用含利巴韋林方案治療,考慮治療對母親重要性。還見利巴韋林處方資料。
兒童使用
尚未在兒童中確定Sovaldi的安全性和有效性。
老年人使用
Sovaldi被給予90例65歲和以上受試者。跨越治療組超過65歲受試者觀察到的反應率與較年輕受試者相似。老年患者有理由無需調整Sovaldi劑量。
腎受損
對有輕度或中度腎受損患者無需調整Sovaldi的劑量。在有嚴重腎受損(eGFR<30mL/min/1.73m2)或腎病終末期(ESRD)需要血液透析患者中尚未確定Sovaldi的安全性和療效。對有嚴重腎受損或ESRD患者不能給出劑量建議。對CrCl<50mL/min患者還參閱利巴韋林和聚乙二醇干擾素α處方資料。
肝受損
對有輕度,中度或嚴重肝受損(Child-Pugh類別A,B或C)患者無需調整Sovaldi的劑量。在有失代償肝硬變患者中尚未確定Sovaldi的安全性和療效。對肝失代償中禁忌證見聚乙二醇干擾素α處方資料。
有HCV/HIV-1共-感染患者
在223例HCV/HIV-1共-感染受試者評估Sovaldi的安全性和療效。對在HCV/HIV-1共-感染患者中的給藥建議見劑量和給藥方法(2.1)。在HCV/HIV-1共-感染受試者中的安全性圖形與在HCV單-感染受試者中觀察到相似。在30/32(94%)接受阿扎那韋[atazanavir]作為抗逆轉錄病毒方案部分受試者中觀察到總膽紅素升高(3或4級)。沒有受試者有同時轉氨酶增高。沒有用阿扎那韋受試者中,在2例(1.5%)受試者觀察到3或4級升高的總膽紅素,與在3期試驗接受Sovaldi+利巴韋林HCV單-感染受試者觀察到的發生率相似。
有肝細胞癌等待肝移植患者
在一項有肝細胞癌HCV-感染受試者進行肝移植前開放臨床試驗評價在移植前給予Sovaldi的安全性和療效和利巴韋林預防移植後HCV重新感染中研究Sovaldi。試驗的主要終點是移植後病毒學反應(pTVR)被定義為在移植後12周時HCVRNA<低於定量低限(LLOQ)。HCV-感染受試者,不管基因型,有肝細胞癌(HCC)符合MILAN標準(被定義為有單個肝細胞癌患者中存在一個腫瘤直徑5cm或以下和有多個腫瘤患者中沒有多於三個腫瘤結節,各直徑3cm或以下和無癌症的肝外表現或腫瘤侵犯血管的證據)接受400mgSovaldi和基於體重1000-1200mg利巴韋林每天共24-48周或直至肝移植時,以先發生為準。對61例接受Sovaldi和利巴韋林受試者進行一項中期分析;45例受試者有HCV基因1型;44例受試者有基線肝臟Child-Pugh-Turcotte[CPT]評分低於7和所有受試者有一個基線未校正MELD評分≤14。在這些61例受試者中,用Sovaldi和利巴韋林治療48周后41例受試者進行肝移植;在移植時37例有HCVRNA<LLOQ。在這37例受試者中,在這36例已達到移植後時間點12周可評價的受試者,移植後病毒學反應(pTVR)率是64%(23/36)。在肝移植前HCV-感染受試者Sovaldi和利巴韋林的安全性圖形與在3期臨床試驗中用Sovaldi和利巴韋林治療受試者觀察到有可比性。
肝移植後患者
尚未確定在肝移植後患者中Sovaldi的安全性和療效。
有HCV基因5或6型感染CHC患者
對有HCV基因5或6型感染受試者可得到數據不充分不能對給藥建議。
藥物過量
Sofosbuvir的最高記錄劑量是單純超治療劑量sofosbuvir1200mg給予59例健康受試者,在該試驗中,在這個劑量水平未觀察到不良反應,而不良事件頻數和嚴重程度與安慰劑和sofosbuvir400mg治療組相似。不知道更高劑量的效應。
對用Sovaldi過量不能得到專門的抗毒藥。如發生過量必須監視患者對毒性的證據。用Sovaldi過量的治療由一般支持措施組成包括監視生命徵象以及患者臨床狀態的觀察。一個4小時血液透析階段去除給藥劑量的18%。
一般描述
Sovaldi是sofosbuvir的商品名,一種HCVNS5B聚合酶的核苷酸類似物抑制劑。
對sofosbuvir的IUPAC名為(S)-Isopropyl2-((S)-(((2R,3R,4R,5R)-5-(2,4-dioxo-3,4-dihydropyrimidin-1(2H)-yl)-4-fluoro-3-hydroxy-4-methyltetrahydrofuran-2-yl)methoxy)-(phenoxy)phosphorylamino)propanoate,分子式C22H29FN3O9P和分子量529.45。有以下結構式:
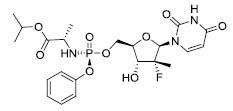 分子式
分子式Sofosbuvir是一種白色至灰白色結晶固體,在37°C跨越pH範圍2-7.7溶解度為≥2mg/mL和微溶於水。
Sovaldi片是為口服給藥。每片含400mg的ofosbuvir。片包括以下無活性成分:膠體二氧化矽,羧甲基纖維素鈉,硬脂酸鎂,甘露醇,和微晶纖維素。片是薄膜包衣有包衣材料含以下無活性成分:聚乙二醇,聚乙烯醇,滑石,二氧化鈦,和氧化鐵黃,.
臨床藥理學
作用機制
Sofosbuvir是一種對C型肝炎病毒直接作用抗病毒藥。
藥效動力學
對心電圖的影響
在59例健康受試者一項隨機化,單劑量,安慰劑-,和陽性對照(莫西沙星[moxifloxacin]400mg)四階段交叉徹底QT試驗評價sofosbuvir400和1200mg對QTc間期的影響。在劑量三倍於最大推薦劑量,Sovaldi不延長QTc至任何臨床相關程度。
藥代動力學
吸收
在健康成年受試者和在有慢性C型肝炎受試者曾評價sofosbuvir和主要循環代謝物GS-331007的藥代動力學性質。OVALDI的口服給藥後,sofosbuvir被吸收在給藥後~0.5-2小時觀察到血漿峰濃度,不管劑量水平。給藥後2至4小時間觀察到GS-331007血漿峰濃度。根據有基因1至6型HCV感染受試者利巴韋林(有或無聚乙二醇化干擾素)共同給藥群體藥代動力學分析,穩態sofosbuvir(N=838)和GS-331007(N=1695)AUC0-24幾何均數分別為828ng•hr/mL和6790ng•hr/mL。相對於健康受試者,在HCV-感染受試者中單獨給予sofosbuvir(N=272),sofosbuvirAUC0-24分別為較高39%而GS-331007AUC0-24分別較低39%。跨越200mg至1200mg的劑量範圍Sofosbuvir和GS-331007的AUCs是接近劑量正比例。
食物的影響
相對於空腹條件,單劑量Sovaldi與一個標準高脂肪餐給予沒有大幅影響sofosbuvirCmax或AUC0-inf。存在高脂肪餐GS-331007的暴露沒有改變。因此,Sovaldi可不考慮食物給予。
分布
Sofosbuvir是約61-65%結合至人血漿蛋白和藥物濃度跨越範圍1µg/mL至20µg/mL結合與藥物濃度無關。在人血漿中GS-331007的蛋白結合很小。健康受試者給予單劑量400mg的[14C]-sofosbuvir,血液與血漿14C-放射性比值約為0.7。
代謝
Sofosbuvir在肝臟中被廣泛地代謝形成藥理學活性核苷酸類似物三磷酸GS-461203。代謝激活通路涉及羧基酯部分被人組織蛋白酶(cathepsinA,CatA)或羧酸酯酶1(CES1)的催化連續水解和磷酸酯被組氨酸三聯體核苷酸結合蛋白1(HINT1)裂解接著被嘧啶核苷酸的生物合成通路磷酸化。去磷酸化導致核苷代謝物GS-331007的形成,不能有效地重新磷酸化和缺乏體外抗-HCV活性。
在單次400mg口服劑量[14C]-sofosbuvir後,sofosbuvir和GS-331007分別約占藥物相關物質(sofosbuvir及其代謝物的AUC校正分子量和)全身暴露的4%和>90%。
消除
單次400mg口服給予[14C]-sofosbuvir,平均總回收劑量是大於92%,在尿,糞,和呼氣中分別回收約80%,14%,和2.5%。在尿中回收sofosbuvir劑量的大多數是GS-331007(78%)而3.5%回收為sofosbuvir。這些數據表明對GS-331007腎清除是主要消除途徑。Sofosbuvir和GS-331007的中位末端半衰期分別是0.4和27小時。
特殊人群
種族
在HCV-感染受試者群體藥代動力學分析表明種族對sofosbuvir和GS-331007的暴露無臨床相關影響。
性別
對sofosbuvir和GS-331007未觀察到男性和婦女間臨床相關藥代動力學差別。
兒童患者
尚未確定在兒童患者中sofosbuvir的藥代動力學。
老年患者
在HCV-感染受試者群體藥代動力學分析顯示在分析的年齡範圍內(19至75歲),年齡對sofosbuvir和GS-331007的暴露沒有臨床上相關影響。
有腎受損患者
在HCV陰性受試者有輕度(eGFR≥50和<80mL/min/1.73m2),中度(eGFR≥30和<50mL/min/1.73m2),嚴重腎受損(eGFR<30mL/min/1.73m2)和有腎病終末期(ESRD)需要血液透析受試者在單次400mg劑量sofosbuvir後研究sofosbuvir的藥代動力學。相對於有正常腎功能受試者(eGFR>80mL/min/1.73m2),在輕度,中度和嚴重腎受損受試者,sofosbuvirAUC0-inf分別為較高61%,107%和171%;而GS-331007AUC0-inf分別為較高55%,88%和451%。在有終末腎病ESRD受試者,相對於有正常腎功能受試者,sofosbuvir和GS-331007AUC0-inf分別為較高28%和1280%當sofosbuvir是透析前1小時給予與當透析後1小時給予比較較高60%和2070%。一個4小時期間血液透析去除約給藥劑量的18%。對有輕度或中度腎受損患者無需劑量調整。尚未在有嚴重腎受損或ESRD患者中確定Sovaldi的安全性和療效。對有嚴重腎受損或ESRD患者不能給予劑量的建議。
有肝受損患者
有中度和嚴重肝受損在HCV-感染受試者(Child-Pugh類別B和C)給予400mgsofosbuvir7-天后研究sofosbuvir的藥代動力學。相對於有正常肝功能受試者,中度和嚴重肝受損sofosbuvirAUC0-24分別為較高126%和143%,而GS-331007AUC0-24分別較高18%和9%。在HCV-感染受試者中群體藥代動力學分析表明肝硬變對sofosbuvir和GS-331007的暴露無臨床上相關影響.建議對有輕度,中度和嚴重肝受損患者無需調整Sovaldi劑量。
藥物相互作用的評估
在表6中顯示共同給藥藥物對sofosbuvir和GS-331007暴露的影響。
表7顯示sofosbuvir對共同給藥藥物暴露的影響。
 表7
表7 表6
表6用拉替拉韋未觀察到對sofosbuvirandGS-331007藥代動力學參數的影響。
用sofobuviry與以下藥物共同給藥後觀察對藥代動力學參數的影響:環孢黴素[cyclosporine],達蘆那韋/利托那韋[darunavir/ritonavir],依非韋倫[efavirenz],恩曲他濱[emtricitabine],美沙酮[methadone]或利匹韋林[rilpivirine].
微生物學
作用機制
Sofosbuvir是一種病毒複製所必需的HCVNS5BRNA-依賴RNA聚合酶的抑制劑。Sofosbuvir是一種核苷酸前藥在細胞內進行代謝形成藥理學活性尿嘧啶類似物三磷酸(GS-461203),通過NS5B聚合酶可摻入至HCVRNA和作用如同鏈終止物。在一個生化分析中,GS-461203抑制來自HCV基因1b,2a,3a和4a型重組NS5B的聚合酶活性,有IC50值範圍從0.7至2.6µM。GS-461203不是人類DNA和RNA聚合酶的抑制劑也不是線粒體RNA聚合酶的抑制劑。
抗病毒活性
在HCV複製子分析,sofosbuvir的EC50值對全長複製子來自基因1a,1b,2a,3a和4a型,和嵌合1b複製子編碼NS5B來自基因2b,5a或6a型範圍從0.014至0.11µM。對嵌合複製子編碼NS5B序列來自臨床分離株sofosbuvir的中位EC50值為0.062µM對基因1a型(範圍0.029-0.128μM;N=67),0.102µM對基因1b型(範圍0.045-0.170μM;N=29),0.029µM對基因2型(範圍0.014-0.081μM;N=15)和0.081µM對基因3a型(範圍0.024-0.181μM;N=106)。在感染性病毒分析中,對基因1a和2a型sofosbuvir的EC50值分別為0.03和0.02µM。存在40%人血清對sofosbuvir的抗-HCV活性沒有影響。在複製子細胞中Sofosbuvir與干擾素α或利巴韋林聯用的評價顯示在減低HCVRNA水平無拮抗作用。
耐藥性
在細胞培養中
在細胞培養中對多個基因型包括1b,2a,2b,3a,4a,5a和6a曾被選擇對sofosbuvir敏感性減低的HCV複製子,對sofosbuvir敏感性減低伴隨在被檢查所有複製子基因型主要NS5B替代S282T,在基因2a,5和6型複製子中與S282T替代同時發生一個M289L替代。在8個基因型的複製子中S282T取代的位點指向突變發生賦予2-至18-倍對sofosbuvir減低敏感性和與相對應野生野生型比較減低複製病毒能力89%至99%。在生化分析中,來自基因型1b,2a,3a和4a重組NS5B聚合酶表達S282T取代顯示與相應野生型比較減低對GS-461203敏感性。
在臨床試驗中
在一項3期試驗982例接受Sovaldi受試者的合併分析,224例受試者有基線後NS5B基因型數據來自下一代核苷酸測序(分析截斷1%).
跨越3期試驗來自GT3a-感染受試者在基線後樣品檢測治療-出現取代L159F(n=6)和V321A(n=5)。有L159F或V321A取代受試者分離株對sofosbuvir的表型敏感性無見可檢測到的移動。在基線或來自3期試驗失敗分離株未檢測到sofosbuvir-伴隨耐藥性取代S282T。但是,在2期試驗P7977-0523[ELECTRON]sofosbuvir單藥治療12周后一例基因2b型治療後第4周復發的受試者檢測到一個S282T取代。來自這個受試者的分離株顯示對sofosbuvir靈敏性減低均數13.5-倍。對這個受試者,治療後第12周用有分析截斷1%下一代測序不再檢測到S282T取代。
在有肝細胞癌等待肝移植受試者進行試驗中其中受試者接受至48周sofosbuvir和利巴韋林,在多個有GT1a或GT2bHCV經歷病毒學失敗受試者(突破和復發)出現L159F取代。此外,在多個感染有GT1bHCV受試者,在基線時存在L159F和/或C316N取代是伴隨移植後sofosbuvir突破和復發。此外,在一例感染有GT1aHCV受試者用-治療有部分治療反應通過下一代測序被檢測到S282R和L320F取代。
交叉耐藥性
HCV複製子表達sofosbuvir-伴耐藥性取代S282T是對NS5A抑制劑和利巴韋林敏感。HCV複製子表達利巴韋林-伴取代T390I和F415Y是對sofosbuvir敏感。Sofosbuvir對HCV複製子有NS3/4A蛋白酶抑制劑,NS5B非-核苷抑制劑和NS5A抑制劑耐藥突變體有活性。.
非臨床毒理學
癌發生,突變發生,生育能力受損
癌發生和突變發生
使用利巴韋林和/或聚乙二醇干擾素α:利巴韋林在幾種體外和體內試驗中顯示有遺傳毒性。利巴韋林在一項6-月p53+/-轉基因小鼠研究或一項2-年致癌性研究在大鼠中沒有致癌性。見對利巴韋林處方資料。
正在小鼠和大鼠中進行sofosbuvir的致癌性研究。
在一組體外或體內試驗,包括細菌致突變性,用人外周血淋巴細胞染色體致畸和體內小鼠微核試驗Sofosbuvir沒有致遺傳毒性。
生育能力受損
使用利巴韋林和/或聚乙二醇干擾素α:在雄性動物生育能力研究,利巴韋林誘發可逆性睪丸毒性,而聚乙二醇干擾素α可能損害雌性生育能力,為另外信息對利巴韋林和聚乙二醇干擾素α參閱處方資料。
當在大鼠中評價在最高測試劑量,對主要循環代謝物GS-331007AUC暴露約為人在推薦臨床劑量暴露8-倍時Sofosbuvir對胚胎-胎兒生存能力或對生育能力無影響。.
動物毒理學和/或藥理學
在大鼠中GS-9851後(含立體異構體混合物約50%sofosbuvir)劑量2000mg/kg/day直至5天后觀察到心臟退行性變性和炎症。在這個劑量,對主要代謝物GS-331007AUC暴露高於人暴露在推薦臨床劑量約29-倍。在大鼠中sofosbuvir劑量至500mg/kg/day共6個月在GS-331007AUC暴露較高於推薦臨床劑量人暴露約9-倍後未觀察到心臟退行性變性或炎症。在犬和小鼠,sofosbuvir劑量至500和1000mg/kg/day最高測試劑量分別共9和3個月後未觀察到心臟退行性變性和炎症。在這些劑量,GS-331007AUC暴露比在推薦臨床劑量人暴露分別約較高27-和41-倍。
臨床研究
臨床試驗的描述
在五項3期試驗在總計1724例有基因型1至6慢性C型肝炎(CHC)HCV單-感染受試者和1項3期試驗在223例有基因型1,2或3CHCHCV/HIV-1共-感染受試者中評價Sovaldi的安全性和療效。在五項HCV單-感染受試者試驗中,一項是在治療過受試者有CHC基因型1,4,5或6與聚乙二醇干擾素α2a和利巴韋林聯用中進行和其他四項有CHC基因2或3型受試者與利巴韋林聯用,包括一項在未治療過受試者,一項在干擾素不能耐受,不合格或不願意受試者,一項在既往用基於干擾素方案治療受試者,和一項在所有不管既往治療史或採用干擾素能力受試者中進行試驗。在HCV/HIV-1共-感染受試者與利巴韋林聯用有CHC基因1型在未治療過受試者和所有有CHC基因2或3型不管既往治療史或採用干擾素能力的受試者中進行試驗。在這些試驗中受試者有代償性肝臟疾病包括肝硬變。Sovaldi被給予劑量400mg每天1次。利巴韋林(RBV)劑量是基於體重[weight-based]在1000-1200mg每天分兩劑給藥當與Sovaldi聯用,而聚乙二醇干擾素α2a劑量,如適用時,為180µg每周。在每個試驗治療時間固定和不是由受試者的HCVRNA水平指導(無反應指導算法)。在臨床試驗期間用COBASTaqManHCV測試(版本2.0),為與高純系統使用,測量血漿HCVRNA值。分析的定量低限(LLOQ)為25IU/mL。主要終點為持續病毒學反應(SVR),被定義為在治療結束後第12周時HCVRNA低於LLOQ。
在有CHC基因1或4型受試者中臨床試驗
未治療過成年─NEUTRINO(研究110)
NEUTRINO是一項在有HCV基因1,4,5或6型感染未治療過受試者中開放,單臂試驗評價用SOVALD與聚乙二醇干擾素α2a和利巴韋林聯合治療12周,與預先指定的歷史對照比較。
被治療受試者(N=327)有中位年齡54歲(範圍:19至70);64%受試者為男性;79%為白人,17%為黑人;14%為西班牙或拉丁美洲裔;平均體重指數為29kg/m2(範圍:18至56kg/m2);78%有基線HCVRNA大於6log10IU/mL;17%有肝硬變;89%有HCV基因1型;9%有HCV基因4型和2%有HCV基因5或6型。
表8展示對Sovaldi+聚乙二醇干擾素α+利巴韋林治療組的反應率。
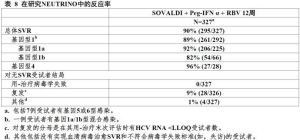 表8
表8表9中展示選定亞組的發生率。
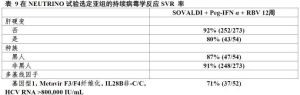 表9
表9在有基線IL28BC/C等位基因受試者中SVR率為98%(93/95)和在有基線IL28B非-C/C等位基因受試者中為87%(202/232)。
在NEUTRINO中有多個基線因子傳統上伴隨對基於干擾素治療反應較低受試者在既往聚乙二醇化干擾素和利巴韋林治療失敗患者中估計的反應率將接近觀察反應率(表9)。在NEUTRINO試驗中在基因1型受試者有IL28B非-C/C等位基因,HCVRNA>800,000IU/mL和MetavirF3/F4纖維化持續病毒學反應SVR率為71%(37/52).
在有基因型2或3CHC受試者臨床試驗
未治療過成年─FISSION(研究1231)
FISSION是在有HCV基因2和3型未治療過受試者的一項隨機化,開放,陽性-對照試驗評價用Sovaldi和利巴韋林治療12周與of用聚乙二醇干擾素α2a和利巴韋林治療24周比較。在Sovaldi+利巴韋林和聚乙二醇干擾素α2a+利巴韋林臂組利巴韋林所用劑量分別為基於體重1000-1200mg每天和800mg每天不管體重。受試者被以1:1比例隨機化和stratified按肝硬變分層(存在相比缺乏),HCV基因型(2相比3)和基線HCVRNA水平(<6log10IU/mL相比≥6log10IU/mL)。被納入有HCV基因2或3型受試者比值約為1:3。
被治療受試者(N=499)有中位年齡50歲(範圍:19至77);66%受試者為男性;87%為白人,3%為黑人;14%為西班牙或拉丁美洲;均數體重指數為28kg/m2(範圍:17至52kg/m2);57%有基線HCVRNA水平大於6log10IU/mL;20%有肝硬變;72%有HCV基因3型。表10展示對Sovaldi+利巴韋林和聚乙二醇干擾素α+利巴韋林治療組的反應率。
表11按基因型展示對在基線時有肝硬變受試者的反應率。
 表11
表11干擾素不能耐受,不合格或不願意成年─POSITRON(研究107)
POSITRON是在干擾素不能耐受,不合格或不願意受試者一項隨機化,雙盲,安慰劑-對照試驗評價用Sovaldi和利巴韋林治療12周(N=207)與安慰劑(N=71)比較。受試者以3:1比值被隨機化和stratified按肝硬變(存在相比缺乏)分層。
被治療受試者(N=278)有中位年齡54歲(範圍:21至75);54%受試者為男性;91%為白人,5%為黑人;11%為西班牙或拉丁美洲;平均體重指數為28kg/m2(範圍:18至53kg/m2);70%有基線HCVRNA水平大於6log10IU/mL;16%有肝硬變;49%有HCV基因3型。干擾素不能耐受,不合格,或不願意受試者的比例分別為9%,44%,和47%。大多數受試者無既往HCV治療(81%)。
表12展示對Sovaldi+利巴韋林和安慰劑治療組的反應率。
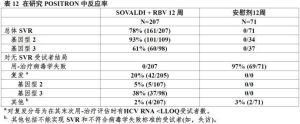 表12
表12表13展示按基因型對肝硬變和干擾素分類亞組分析。
 表13
表13既往治療過成年─FUSION(研究108)
FUSION是一項在用既往基於干擾素治療未實現SVR受試者(復發者和無反應者)中隨機化,雙盲試驗評價用Sovaldi和利巴韋林12或16周治療。受試者以1:1比值被隨機化和按肝硬變(存在相比缺乏)和HCV基因型(2相比3)分層。
被治療受試者(N=201)有中位年齡56歲(範圍:24至70);70%受試者為男性;87%為白人;3%為黑人;9%為西班牙或拉丁美洲;均數體重指數為29kg/m2(範圍:19至44kg/m2);73%有基線HCVRNA水平大於6log10IU/mL;34%有肝硬變;63%有HCV基因3型;75%為既往復發者。
表14展示對Sovaldi+利巴韋林共12周和16周治療組的反應率。
 表14
表14表15展示按基因型對肝硬變和對HCV治療反應的亞組分析。
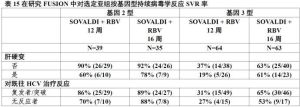 表15
表15未治療過和既往治療過成年─VALENCE(研究133)
VALENCE試驗在HCV基因2或3型感染未治療過受試者或受試者沒有實現SVR用既往基於干擾素治療,包括有代償肝硬變受試者中評價Sovaldi聯用與基於體重利巴韋林對的治療。原先試驗設計是一個4與1隨機化至Sovaldi+利巴韋林共12周或安慰劑。根據出現數據,這個試驗被揭盲和所有HCV基因2型-感染受試者繼續原先計畫治療和接受Sovaldi+利巴韋林共12周,和在基因3型HCV-感染受試者用Sovaldi+利巴韋林治療的時間被延長至24周。在修正時間時11例基因3型受試者早已完成Sovaldi+利巴韋林共12周。
被治療受試者(N=419)有中位年齡51歲(範圍:19至74);60%受試者為男性;均數體重指數為26kg/m2(範圍:17至44kg/m2);均數基線HCVRNA水平為6.4log10IU/mL;78%有HCV基因3型;58%受試者是經歷治療和這些65%受試者對既往HCV治療經歷復發/突破。
表16展示對Sovaldi+利巴韋林共12周和24周治療組的反應率。
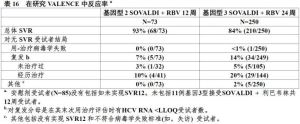 表16
表16表17展示按基因型對肝硬變和既往經歷HCV治療亞組分析。
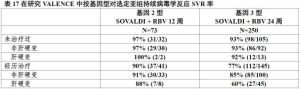 表17
表17在與HCV和HIV-1共-感染受試者臨床試驗
在用基因1,2或3型慢性C型肝炎與HIV-1共-感染受試者中的一項開放臨床試驗中研究SOVALD(研究PHOTON-1)評價用Sovaldi和利巴韋林治療12或24周的安全性和療效。基因2和3型受試者為或HCV未治療過或經歷治療,而基因1型受試者全部都是未治療過。受試者接受400mgSovaldi和基於體重利巴韋林(1000mg對受試者體重<75kg或1200mg對受試者體重≥75kg)每天共12或24周根據基因型和既往治療史。受試者是或不用抗逆轉錄病毒治療有CD4+細胞計數>500細胞/mm3或有病毒學抑制的HIV-1有CD4+細胞計數>200細胞/mm3。可得到對210例受試者治療後12周療效數據(見表18)。
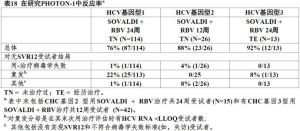 表18
表18在有HCV基因1型感染受試者中,在有基因1a型感染受試者持續病毒學反應SVR率為82%(74/90)和在有基因1b型感染受試者54%(13/24),有復發占治療失敗多數。有HCV基因1型感染受試者在有基線IL28BC/C等位基因受試者中持續病毒學反應SVR率為80%(24/30)和有基線IL28B非-C/C等位基因受試者為75%(62/83)。
在有HIV-1共-感染的223例CHC受試者,治療期間CD4+細胞百分率沒有變化。用Sovaldi+利巴韋林治療共12或24周結束時觀察到中位CD4+細胞計數分別減低85細胞/mm3和84細胞/mm3。在2例用抗逆轉錄病毒治療受試者(0.9%)在Sovaldi+利巴韋林治療期間發生HIV-1反跳。
如何供應/貯存和處置
包裝
Sovaldi片是黃色,膠囊形,薄膜包衣片含400mgsofosbuvir一側凹陷有“GSI”和另一側“7977”。每瓶含28片(NDC61958-1501-1),矽膠乾燥劑,聚酯線圈和用一種阻止兒童蓋關閉。
供應藥房
美國是醫藥分開的國家,藥房全部實行嚴格的處方藥與非處方藥分類管理。對處方藥的銷售,必須憑美國醫生(電子/紙質)處方。如今國內患者可以依託科技,實現遠程的病歷互動,由美國醫生根據患者病情開具電子處方,以正規渠道在美國藥房購買到處方藥。美國好醫友連鎖藥房提供專科藥物、處方藥物、非處方藥物、藥物配置、藥物注射以及各類非住院患者的藥物分發、諮詢、配送等各項服務。
貯存
貯存在室溫低於30°C(86°F)。
● 只在原裝容器內分發。
●如果瓶密封蓋打開破壞或丟失時不要使用。
患者諮詢資料
忠告患者閱讀FDA-批准的患者使用說明書(患者資料)。
妊娠
妊娠婦女或男性其女性伴侶妊娠必須不用利巴韋林。不應開始利巴韋林治療直至開始治療前立即已得到陰性妊娠測試報告。當Sovaldi與聚乙二醇干擾素/利巴韋林或利巴韋林聯用時,患者必須被忠告利巴韋林的致畸胎/殺胚胎風險和應被忠告女性患者和男性患者的女性伴侶治療期間和治療完成後6個月都必須極小心避免妊娠。
育嬰潛能婦女和其男性伴侶治療期間和治療停止後6個月必須使用至少兩種型式有效避孕;在這個時間期間必須進行常規每個月妊娠測試。沒有服用Sovaldi婦女中全身激素避孕藥有效性的數據;因此,應使用兩種另外的非激素避孕方法。
患者應被忠告在妊娠事件中立即通知其衛生保健提供者。已建立一種利巴韋林妊娠註冊監視暴露於利巴韋林妊娠婦女母體和胎兒結局。鼓勵患者通過電話1-800-593-2214註冊。對HCV/HIV-1共-感染患者和同時用抗逆轉錄病毒藥物,也可電話1-800-258-4263得到抗逆轉錄病毒藥物妊娠註冊。
C型肝炎病毒傳播
患者應被告知不知道C型肝炎感染治療對傳播的影響,和C型肝炎病毒治療期間或治療失敗事件中適當注意防止傳播。
給藥
患者應被忠告對患者有HCV基因1或4型感染推薦的方案是Sovaldi與聚乙二醇干擾素α和利巴韋林聯合給藥和對有HCV基因2或3型感染患者推薦方案是Sovaldi與利巴韋林聯合給藥。如聚乙二醇干擾素和/或利巴韋林被永遠終止,Sovaldi也應被終止。
患者應被忠告Sovaldi的劑量必須不要減低和它按規則給藥時間表有或無食物給予。如果某患者在規則時間沒有服Sovaldi,可在這天以後服用。但是,在任何日曆天不應服用超過400mg的Sovaldi。在下一天患者應恢復規則給藥時間表。