簡介
Chichibabin氨基化反應,吡啶(或其衍生物)等含氮雜環鹼類化合物與鹼金屬的氨基化合物共熱時發生胺化生成相應氨基衍生物的反應,稱為Chichibabin氨基化反應。反應通式如下:
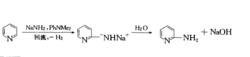 反應式
反應式反應概述
齊齊巴賓(A.E.Chichibabin,1871一1944)蘇聯化學家。1871年生於俄國Poltowa的Gouv。彼德堡(觀列寧格勒)大學博士。他曾在莫斯科、巴黎等地工作過。他對雜環化合物和生物鹼有深刻的研究。
與硝基苯相同,氮苯(即吡啶)也可以發生親核取代反應。如氮苯與NaNH作用,可得到α-氨基氮苯,這就是所謂的Chichibabin吡啶氨基化反應。
1914年Chichibabin首先研究NaNH與吡啶類的化學反應,使—NH引入到吡啶環上。如:
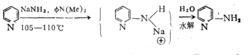 NaNH2與吡啶類的化學反應
NaNH2與吡啶類的化學反應此反應副產物很多。一般產率為50~100%。普通通過硝基還原法制伯胺,但不適用製備氨基吡啶,因為吡啶硝化這一步很難,因此想來用硝基吡啶還原制氨基吡啶不行。所以,齊齊巴賓反應是向吡啶環上引入氨基的有效方法。
如果吡啶α位已被占據,則得γ位氨基吡啶,但產率很低。
含氮雜環鹼類,如吡啶、喹啉或其衍生物都可進行Chichibabin反應。
反應機理
反應機理為親核取代。就吡啶類化合物而言,—NH易進攻吡啶環電子云密度較低的α位(或γ位),然後失去H ,並與氨基吡啶作用放出H,最後經水解生成氨基吡啶:
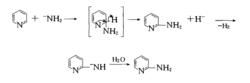 反應機理示意圖
反應機理示意圖套用示例
通常,吡啶類不易硝化,難以用硝基還原法製備氨基吡啶。此反應為雜環上直接引入氨基的簡便方法,廣泛用於各種氮雜環(如苯並咪唑、異喹啉、吖啶、菲啶類等)及其衍生物的胺化。若吡啶環的兩個α位均已有取代基,反應時—NH將進攻γ位;若α位、γ位已有—OH,—SOH,—CONH等基團則發生置換。
含氮雜環鹼類化合物還能與鹼金屬的烴基化合物(如丁基鋰、苯基鋰等)以及Grignard試劑等親核試劑發生“似Chichibabin反應”生成相應的烴基衍生物。
吡啶和氨基鈉的反應
吡啶和固體氨基鈉可以在甲苯或N,N-二甲苯胺中加熱得到2-氨基吡啶鈉鹽,經過水解得到2-氨基吡啶。這個反應是有名的Chichibabin反應。由於這個反應可以在吡啶的2-位引入氨基,2-位的氨基可以通過重氮化反應轉變為其他很多基團,這個反應就顯相當重要。
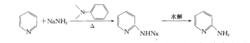 Chichibabin氨基化反應
Chichibabin氨基化反應不少教科書中把這個反應說成是氨基負離子進攻吡啶的2-位的親核取代反應,但是這個反應比較複雜,吡啶和氨基鋰在液氨的溶液中卻不起這個反應,自由基淬滅劑可以終止反應,因此可能是自由基反應。但是異喹啉卻既可和氨基鋰的液氨溶液反應,又可和固體氨基鋰在N,N-二甲基苯胺里反應,二者都生成1-氨基異喹啉。
