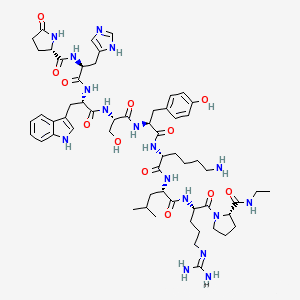
概念
促性腺激素釋放激素是下丘腦分泌產生的神經激素,對脊椎動物生殖的調控起重要作用。種類
自1971年從豬和羊的腦分離出GnRH以來,到目前GnRH家族至少已有28個類型,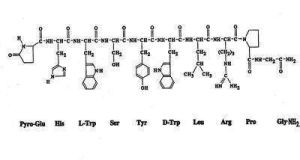 GnRH
GnRH以魚類為例
胺基酸序列分析表明魚類的GnRH-R屬於G-蛋白偶聯受體家族(GPCRs)中視紫紅質亞族中的β-亞群,它們由3個主要功能域組成,包括N-端細胞外功能域,7個跨膜功能域和C-端細胞質功能域。系統發生分析表明魚類的GnRH-R主要有兩個類型,即Ⅰ型和Ⅱ型;每個類型還包括2到3個亞型。編碼不同的GnRH-R類型的基因,具有不同的基因結構。GnRH-R基因的表達主要集中在生殖系統及相關的器官與組織,但每種魚類GnRH-R的不同類型與亞型在組織或細胞中的具體分布有所不同。
促性腺激素釋放激素(gonadotropin-releasing hormone, GnRH)是由下丘腦合成的十肽激素,主要功能是控制卵泡刺激素(FSH)和黃體生成素(LH)的釋放,在性別分化、性腺發育以及生殖過程中起重要調節作用。迄今為止,在人體內發現存在GnRH-I和GnRH-II兩種亞型。已有證據表明,GnRH-I和GnRH-II除了在內分泌系統中發揮核心作用外,還可直接作用於人胎盤的滋養層細胞,促進滋養層細胞侵潤母體子宮,在胎盤發生、建立母胎循環的過程中發揮作用。這兩種GnRH亞型在調節滋養層細胞侵潤行為時卻表現出不同的效應,而關於二者發揮作用的信號通路以及不同效應的分子機制尚不知曉。
中國科學院動物研究所王雁玲研究員領導的研究組與加拿大英屬哥倫比亞大學Peter C.K. Leung教授的研究組合作,利用原代培養的人滋養層細胞作為研究模型,對GnRH-I和GnRH-II作用的分子機制進行了深入研究。結果發現,GnRH-I和GnRH-II都能通過激活PKC、ERK和JNK激酶調節滋養層細胞的侵潤,但是GnRH-II是通過轉導激活EGF受體酪氨酸激酶活性實現上述激酶的激活,而GnRH-I的作用是EGF受體非依賴型的。利用RNA干擾技術敲除I型GnRH受體,只有GnRH-I的促侵潤作用被阻斷,而對GnRH-II的作用沒有顯著影響,表明可能存在新的特異性的GnRH-II受體。該研究首次揭示了人胎盤中GnRH-I和GnRH-II通過不同的受體和信號交聯通路調節細胞侵潤行為,而這種配體依賴性選擇信號通路的機制對於理解不同亞型GnRH在垂體外組織中的生理功能具有重要意義。
以上研究成果最近發表於內分泌學國際權威學術期刊《分子內分泌學》(Molecular Endocrinology (Liu J, MacCalman CD, Wang YL, Leung PC. Molecular Endocrinology. 2009, 23(7):1014-1021))。第一作者劉璟為生殖病理研究組2007年畢業的博士研究生,通訊作者王雁玲為生殖病理研究組組長。這一工作受到國家重大科學研究計畫課題(No. 2006CB944008)和中科院知識創新工程重要方向性項目(Grant No. KSCX2-YW-R-53)資助。
對子宮肌瘤
子宮肌瘤是育齡婦女中較多見的良性腫瘤,目前以手術治療為主。在藥物治療方面,GnRH激動劑是近十幾年來研究較多的一類藥物,在部分圍絕經期婦女及在術前選擇性地使用,有助於肌瘤萎縮、改善貧血和一般狀況。反加療法可以減少副作用,從而延長治療周期、防止復發。近一、二十年來,促性腺激素釋放激素激動劑(Gonadotrophine-releasing hormone agonist,GnRH-a)在婦科疾病中的套用逐漸受到關注。目前,它的研究和套用領域主要包括雌激素依賴性疾病,如治療子宮內膜異位症、子宮肌瘤、子宮內膜癌、乳腺癌、多毛症、功能性子宮出血以及用於促排卵等。GnRH-a套用於子宮肌瘤的研究始於80年代中,在國外,部分製劑已套用於臨床。
結構及其機制
內源性GnRH是由下丘腦合成並釋放的十肽激素,通過垂體門脈系統作用於垂體前葉(腺垂體)的GnRH受體,促使垂體合成並釋放LH、FSH。GnRH-a是一類人工合成的GnRH衍生物,可以與GnRH競爭GnRH受體,短期表現為促LH、FSH的刺激效應,若持續給藥則可以使GnRH受體發生降調節,並改變受體後效應,抑制LH和FSH的合成與釋放,從而進一步抑制卵巢合成釋放雌、孕激素的功能,造成人工絕經(假絕經)狀態。子宮肌瘤是育齡婦女的常見病,但其發生髮展的原因目前並不是完全清楚,一般認為起因於細胞突變,其生長和女性激素、局部生長因子的相互作用有關; 雌激素(E)的作用已為人們普遍接受,孕激素(P)的作用也日益受到重視。臨床上觀察到,肌瘤往往發生於育齡婦女,妊娠或雌激素替代治療將促進肌瘤生長,卵巢切除或絕經後肌瘤自然萎縮,提示雌激素水平和子宮肌瘤的生長有關。分子水平上的研究顯示,子宮肌瘤中雌、孕激素受體的表達及對激素的敏感性要高於正常子宮肌層。可見性激素水平的變化和肌瘤的發生髮展或萎縮密切相關。GnRH-a造成的低女性激素狀態(尤其是低雌激素狀態)是造成肌瘤縮小的主要原因;同時由於肌瘤中GnRH受體的存在而不能排除GnRH-a對肌瘤的直接作用因素;另外GnRH-a治療後子宮及肌瘤的血液供應減少、細胞凋亡增加,這是否是繼發於激素水平變化的效應還有待探討。
療效及問題
GnRH-a治療子宮肌瘤中的研究始於80年代中期。其給藥途徑包括:鼻腔內噴霧,皮下注射,皮下埋植和肌肉注射。前二者需每天給藥,其中鼻腔內給藥生物利用度不高;後二者每月給藥。首次給藥時間一般安排在晚黃體期或早卵泡期,以避開E2和GnRH的高峰期。十多年來的研究表明,使用GnRH-a 3~6個月就可以使大多數增大的子宮或子宮肌瘤的體積縮小30%~70%,同時症狀減輕,貧血得到糾正,病人的一般狀況改善,部分不孕的患者用藥後懷孕。用藥期間,病人發生可逆性的卵巢功能減退,LH、FSH、E、P均顯著降低,E水平降至絕經後水平,這種低雌激素狀態對於治療的療效是必需的。治療時停止的月經在停藥後4~8周能恢復,少數病人則進入絕經期。同時,在套用GnRH-a治療子宮肌瘤的效果存在個體差異,有些病人肌瘤的體積可以減小80%,但個別病人卻無效。GnRH-a的副作用主要包括:[1]治療初期性激素的急速上升及其後的急劇下降(即興奮期)造成的月經過多(42%)、乳腺疼痛(14%)、性慾增加(3%)、粉刺(4%)等;[2]低雌激素狀態造成的更年期和絕經期症狀:如潮熱(91%)、失眠(55%)、陰道乾澀(37%)、性慾減退(5%)等;[3]其它:情緒不穩定(45%)、頭痛(39%)、關節和肌肉疼痛(25%)、脫髮(18%)、水腫(12%)、抑鬱(9%)、乏力(8%)、皮疹(7%)、短期記憶力喪失(6%)、食慾下降(3%)、視力模糊(2%)等。其中最常發生的副作用為潮熱,部分可出現不規則陰道出血。但大多數病人可耐受,並能堅持治療,停藥後副作用很快消失(1個月左右)。已知絕經後婦女的骨量丟失有一個早期加速的過程,這一過程持續達5~10年,卵巢切除後造成雌激素的急速下降使骨量丟失更快,GnRH-a治療子宮肌瘤的情況是類似的。由於在種族、藥物的種類和劑量、治療時間、測定手段和部位等方面的不同,使各實驗之間缺乏可比性,所以目前還沒有在骨丟失的確切程度、受累骨骼的部位、骨丟失的可逆性方面達成一致。但絕大多數研究表明:使用6~9個月的GnRH-a將造成骨密度的顯著下降。而停藥後骨質恢復的情況則報導不一,多數研究顯示停藥6個月後腰椎骨密度恢復到治療前水平,但另外一些研究則顯示即使停藥6個月,骨密度仍然低於基礎值3.3~4.2%。Taga等[4]在28名日本婦女中連續使用GnRH-a(nafarelin 400ug/d)6個月,3個月和6個月時骨密度下降分別為2.2%和3.25%,停藥3個月後繼續下降達3.89%,停藥6個月骨密度雖有所恢復,但與基礎值相比仍有顯著差異;降低至30pg/ml以下的雌激素水平在停藥後很快恢復;在反映骨代謝的生化指標中,升高的尿鈣/肌酐水平停藥後很快恢復,而鹼性磷酸酶和osteocalcin(骨鈣素)在第3、6、9月時均比基礎值顯著升高。因此,單獨套用GnRH-a治療子宮肌瘤很少超過6個月。
GnRH-a治療子宮肌瘤另一大問題在於:一旦停止治療,在短期內(3~6個月內)肌瘤會重新長大,子宮的大小甚至恢復到治療前水平,儘管臨床症狀可以得到較長時間的緩解。研究表明:GnRH-a治療後肌瘤的雌、孕激素受體有所增加,很快恢復的卵巢功能導致性激素水平的恢復,從而使肌瘤易於復發。這就需要在某些病人身上套用較長時間的GnRH-a。但低雌激素造成的潮熱、盜汗等血管運動功能障礙和骨質疏鬆使長期套用GnRH-a受到了限制。所以,大多數學者推薦在部分有症狀的圍絕經期婦女中、或在手術前有選擇地套用2~3個月的GnRH-a製劑作為輔助治療,而不能替代手術治療。總之,需針對病人的具體情況(年齡、症狀、有無生育要求及不育、習慣性流產等)採取相應的治療措施。
手術期的利弊
Crosignani PG等總結了十餘年來子宮肌瘤手術前套用GnRH-a的情況(如表所示)。在術前只需2~3月的治療即可以達到最佳效果,同時降低費用,減少副反應的發生。其最大的好處在於糾正貧血,改善一般狀況,減少輸血機會及其導致的不良後果;其次可以減少手術創傷,縮小的子宮及肌瘤有利於行宮腔鏡下肌瘤剔除術或經陰道子宮切除術。但還沒有證據表明術前使用GnRH-a能顯著縮短手術時間、降低出血量和術後病率。其不利的一面除了費用較高外,在極少數情況下肌瘤可能發生變性或局部壞死,從而可能不利於肌瘤的剔除。在術後肌瘤復發方面,Fedel等提出由於GnRH-a使一些縮小的肌瘤在手術時不易被發現並剔除,導致與術前未行GnRH-a治療而直接手術的病例相比更易在短期內復發。但Friedman等的結果卻表明:術前套用三個月的GnRH-a(leuprolide acetate depot,LA)後,在隨訪2~3年期間並不增加復發率及相關症狀。
Sudik等的研究表明:對於不育的患者,肌瘤剔除術後的妊娠率與術前是否使用GnRH-a無關。
表:子宮肌瘤手術前使用GnRH-a的優點
肌瘤剔除術後套用GnRH-a防止復發方面,Vavala等將65名病人分成治療組和對照組,治療組術後用LA三年(每年3個月),其子宮體積和復發率顯小於對照組。
減少副作用
一、療效的預測:個體對GnRHa的治療反應存在著差異。與療效相關的因素包括:體重、治療期間血清雌激素水平、治療前肌瘤的體積和病理特點。Friedman等在104個病人中套用LA至少12周,將年齡、身高、體重、治療前子宮體積、治療前及治療12周時血清雌二醇E2水平與療效進行相關性分析,結果顯示:治療12周時血清E2水平和體重與療效負相關,其它因素與療效無顯著相關,即E2<=30pg/ml和E2>30pg/ml者的子宮體積縮小分別為43.13.3%和18. 5.3%,差異顯著;肥胖婦女療效差於正常體重婦女,可能是由於肥胖者體內有較多的雄激素轉化為雌激素;但研究未發現體重與E2水平有關聯。Berverly等對40個病例的研究表明:用buserlin治療前肌瘤的體積、治療期間E2水平與療效顯著相關,肌瘤大、E2低者療效好,而年齡與療效無關。Kawamura等則在治療前行肌瘤活檢,分析病理結果與療效的關係,結果顯示:玻璃樣變輕、膠原含量低或細胞密集度大者肌瘤縮小程度大,前二者與療效顯著相關,而後者與療效的相關性不顯著。顯然,預測療效的指標是多樣化的,要準確地預測療效仍是一個難題。
二、在減少副作用,防止肌瘤復發方面的研究:
由於肌瘤容易在停藥後復發,而GnRH-a的長期使用受到低雌激素血症引起的諸如骨質疏鬆、更年期/絕經期症狀等副作用的限制,在如何解決這一矛盾的研究方面,反加療法(add back therapy)受到了較多的研究。理想的反加治療要求在不影響GnRH-a治療效果的同時能有效地抑制血管運動功能失調和骨密度的降低。包括激素替代治療和非激素反加療法。
(一) 激素替代治療(HRT):
Hornstein等套用LA(3.75mg/4w)治療子宮內膜異位症(EM)時,孕激素(炔諾酮5mg/d)或同時合併小劑量雌激素(0.625mg/d),可以顯著改善患者的症狀,並能有效地抑制骨質吸收、防止骨質疏鬆的發生,不用反加療法者雖然症狀減輕但骨密度明顯下降,而同量孕激素聯合較大劑量的雌激素(1.25mg/d)的療效較差。由於孕激素在EM和肌瘤中扮演了相反的角色,所以情況不完全相同。20mg/d的安宮黃體酮(MPA)可以預防絕經期症狀及骨質疏鬆的發生,但在治療的同時或後期使用MPA,雖然可以減少副作用的發生,但肌瘤的體積無顯著縮小,這可以從孕激素促進肌瘤生長得到解釋。雌、孕激素聯合套用被認為是有效的反加替代治療。Friedman等首次在6例患者中單獨套用LA三個月,然後聯合使用雌激素(0.625mg/d,每月第1-25天)和孕激素(MPA10mg/d,每月第16-25天),連續使用2年,肌瘤沒有復發,潮熱減輕,骨質吸收受到抑制。其它作者套用這一方案同樣取得了較好的效果。Friedman等在另一項對26個病例的前瞻性研究中,仍然用LA 3個月,以後聯合套用estropipate (硫酸雌酮哌嗪)0.75mg/d和每月第1~14天的norethindron(炔諾酮)0.7mg/d,共52周,潮熱減輕,3月時骨密度降低2.7%(P< 0.05),1年時為2.0%,與基礎值無顯著差異(P> 0.05)。一般認為雌激素會刺激肌瘤的生長,而在治療過程中使用HRT卻即能減少副作用,同時不引起肌瘤復發,Barbieri RL及Friedman的解釋是:GnRH-a使體內雌激素水平降至20pg/ml以下,從而使肌瘤萎縮,而40pg/ml的雌激素水平可以減少骨質吸收並且不刺激肌瘤生長,使用0.625mg/d的雌激素,並用適量孕激素可使雌激素水平保持在使肌瘤復發的閾值以下成為可能。所以需要先用GnRH-a治療三個月使肌瘤體積減小到近最大限度,然後聯合套用激素替代治療維持療效。由於樣本量的限制,該雌激素視窗的具體範圍目前還處於探索階段。
(二)在非激素反加治療方面: 二磷酸鹽、降鈣素等是絕經期治療骨質疏鬆的輔助用藥,但在套用GnRHa治療子宮肌瘤的同時使用這些藥物是否有效方面尚無報導,但顯然這些製劑不能減少潮熱的發生,需另外補充其它藥物。
(三)其它:
除反加療法外,Leo等在連續套用goserelin 或triptorelin 6個月後,改用小劑量的丹那唑(Danazol)100mg/d, 6個月,與僅用triptorelin 6個月的對照組相比,兩組在停止GnRH-a治療後平均65天月經周期恢復,激素測定顯示卵巢功能亦恢復,只有5/21的治療組病人維持停經狀態,所有病人的絕經期症狀均隨之消失;後6個月中治療組基礎雌激素水平始終低於對照組,9個月時分別為4和58,12個月時分別為5和7;其它激素水平(LH,FSH,黃體酮,泌乳素)兩組無顯著差異;6個月後,兩組均有肌瘤的緩慢復發,但治療組子宮體積的再次增大要比對照組小31.2%;兩組的骨密度均有顯著性的恢復,但治療組的骨密度恢復更快,即使處於停經狀態的病例也不例外。作者認為該結果主要與丹那唑的抗孕激素效應有關。
這些在製劑和用法方面的不斷嘗試,都為藥物治療子宮肌瘤提供了新的途徑和想法。如果長期治療得以成為可能,那么對於絕經前婦女、手術危險大或不願手術的病人不啻是一福音。
用途
胚胎工程
促性腺激素在胚胎工程重要用途。向雌性動物注射促性腺激素,可以促進其超數排卵。對供體雌性動物和受體動物注射促性腺激素,可以促進其同期發情,從而提高胚胎在受體雌性動物體內的成活幾率。生殖調控
使下丘腦分泌產生的神經激素,對脊椎動物生殖的調控起重要作用。為10個胺基酸的肽,目前已能人工合成。能使黃體生成素釋放,也能使促卵泡激素釋放。較集中分布於正中隆起外側區,弓狀核、下丘腦視前區、多突室管膜細胞、松果體等處也有分布。鑑別
在含量測定項下記錄的色譜圖中,供試品峰的保留時是應與對照品峰的保留時間一致。取本品與戈那瑞林對照品,分別加水製成每1ml中約合1mg的溶液。照其他肽類頂下的色譜條件,吸取上述兩種溶液各10μl,分別點於同一矽膠G薄層板上進行試驗,供試品所顯主斑點的顏色和位置應與對照品的主斑點相同。