正文
簡介
腎上腺皮質合成和分泌的一類甾體化合物,主要功能是調節動物體內的水鹽代謝和糖代謝。在各種脊椎動物中普遍存在。
結構
從腎上腺皮質中可提取出數十種甾醇類結晶,其中脫氧皮質酮 (DOC)、皮質酮、脫氫皮質酮、醛甾酮、脫氧皮質醇、皮質醇(氫化可的松)及皮質素(可的松)7 種成分又可統稱為腎上腺皮質激素。它們都是孕烷的衍生物,含有21個碳原子,其結構如圖。
功能
 腎上腺皮質激素
腎上腺皮質激素根據目前通行的假說,進入細胞的皮質激素也如其他甾體激素一樣,與細胞內特異受體相結合,經激活後結合細胞核,影響染色質的轉錄作用,誘導新的蛋白質合成,表現為細胞功能的變化。
分類皮質激素按其生理功能可分為糖皮質激素及鹽皮質激素兩類。糖皮質激素以皮質醇的活性最強,具有調節糖、蛋白質和脂肪代謝的功能,可影響葡萄糖的合成和利用、脂肪的動員及蛋白質合成。在肝臟細胞中其效應為增加葡萄糖的形成、糖元的累積、 胺基酸的攝取、RNA及蛋白質(特別是與糖代謝有關的酶系)的合成;在肝臟以外的各種組織如肌肉、皮膚、結締組織等則為抑制葡萄糖的利用、促進脂肪的動員分解、減少蛋白質的合成等。因而糖皮質激素與調控糖代謝的另一重要激素──胰島素的效應正好相反。兩種激素的相對立的作用保證了糖代謝的衡定態,在人及高等動物中,胰島素是起主導作用的激素。糖皮質激素只是在較低級的動物如魚類,才是較重要的調節因素。此外糖皮質激素還具有抗炎及減輕過敏反應的作用,因而臨床使用已有較長歷史,其作用原理尚未明確,但可能與其抑制組織胺的釋放,增強白細胞溶酶體穩定性等效應有關。
糖皮質激素的合成和分泌受垂體分泌的促腎上腺皮質激素(ACTH)所刺激而加速,血液中糖皮質激素水平的升高又反過來抑制促腎上腺皮質激素的產生,形成反饋關係。
鹽皮質激素維持體內正常水鹽代謝不可缺少的激素,其中以醛甾酮的生理效應最強。醛甾酮主要作用於上皮結構(如腎小管和汗腺),促進鈉離子從各種管道回收到組織內,從而減少其排出,並相應地增加鉀離子的排出。醛甾酮作用於上皮組織需經過一定潛伏期方能引起鈉離子運輸加快的效應,這是由於激素與特異的受體蛋白結合後進入細胞核內,先需誘導產生出特異蛋白質(醛甾酮誘導蛋白),後者作用於產生能量的系統、提高鈉泵活性或影響細胞膜對Na 的通透性,才能引起離子運輸的變化。
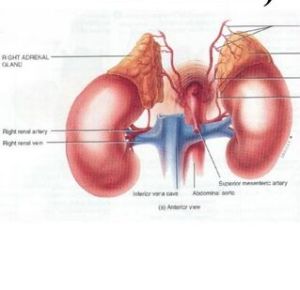
極微量醛甾酮便可產生明顯的生理效應。在其生物合成過程中,ACTH、鉀離子和血管緊張素Ⅰ及Ⅱ均有促使膽甾醇轉化為醛甾酮的效應。其中以腎素-血管緊張素體系的作用最為重要。任何原因造成腎臟出血流的減少均可刺激腎小球旁器的近球細胞分泌腎素,即血管緊張素釋放酶。它作用於血漿中的一種α球蛋白(血管緊張素原),產生無活性的10肽血管緊張素Ⅰ,再經肺循環中的血管緊張素轉化酶作用將其轉化為生物活性極強的八肽血管緊張素Ⅱ。血管緊張素Ⅱ可直接作用於小動脈,促其收縮導致血壓上升,並能促使腎上腺皮質球狀帶細胞合成和分泌醛甾酮。
作用機制
此類藥物的平喘作用機制較為複雜,主要可能與其抗炎作用、免疫抑制作用、增強機體對兒茶酚胺的反應性有關。此外,還可能與抑制磷酸二酯酶增加細胞內cAMP含量,增加肺組織中β受體的密度,具有黏液溶解作用等有關。
臨床套用
皮質激素在臨床上用於:①腎上腺皮質功能不全。②自身免疫性疾病。③變態反應性疾病。④抑制器官移植時的排異。⑤感染性疾病。⑥休克。⑦腫瘤。⑧肝臟疾病。⑨眼科和皮膚疾病。⑩重症肌無力。某些內分泌病的輔助診斷。總之,皮質激素主要用於危重病人的搶救及其他藥物治療無效的某些慢性病,如類風濕性關節炎、頻發性哮喘等。雖然它具有肯定的解熱鎮痛療效,但皮質激素又有過多的嚴重不良反應。
主要品種
常用潑尼松、潑尼松龍、地塞米松。
用法
①大劑量衝擊療法,用於搶救危重病人。
③中程療法(2~3個月),如急性風濕熱。
④長程療法,如類風濕性關節炎等,用藥時間很長,停藥前,必須逐漸減量,以免出現病情反跳。
不良反應
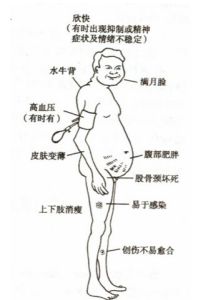
①類皮質功能亢進;
②類固醇性糖尿病;
③肌萎縮和骨質疏鬆;
④誘發和加重感染;
⑤誘發和加重潰瘍;
⑥誘發精神症狀;
⑦並發眼病;
⑧致畸胎;
⑨不恰當地停藥還可能出現皮質功能不足、激素停藥綜合證和症狀反跳等弊病。
禁忌症
皮質激素的禁忌症包括:嚴重精神病;活動性潰瘍病;皮質亢進症;抗菌藥不能控制的感染;骨質疏鬆;中、重度糖尿病;嚴重高血壓;妊娠早期和產褥期。
腎上腺皮質激素是最早用以治療慢性肝炎的免疫調節藥物,數十年來用過促腎上腺皮質激素(ACTH)、氫化考的松、潑尼松和地塞米松等。
輔助治療
(1)暴發性B型肝炎:潑尼松口服或地塞米松靜脈滴注可能使症狀和黃疸減輕,甚至可使急性肝衰竭緩解。
(2)慢性肝炎:潑尼松單一或與其它免疫抑制劑合用,國外直至70年代還是慢性肝炎的常規療法,一些隨機對照的臨床試驗證實可延長生存期、降低病死率。但在HBsAg檢測方法建立後,發現以前報告有效的治療組,包含的大都是HBsA8(—)病例,很可能是自身免疫性肝炎。
聯合治療
 腎上腺皮質激素
腎上腺皮質激素(1)治療方案:潑尼松40mg、30mg和20mg/d各2周,間隔2周后IFNα治療。小兒lmg/(kg·d)1個月,也停2周,等待免疫反跳開始IFNα療程。
(2)治療效果:臨床反跳(血清轉氨酶增高)率40%-70%。我國的慢性HBV感染常有一定程度的免疫耐受性,故聯合治療的效應率比單用α干擾素的顯著較高。曾經單一IFNα治療低效應和無效應的病人,改用聯合治療相當一部分病人可獲得治療效應。
(3)治療機理:潑尼松/IFNα聯合治療深刻影響細胞亞群分布和病毒複製。在健康人的外周血的T細胞中,CD4+細胞約40%,CD8+細胞稍超過20%,CD4/CD8比率近2;慢性B型肝炎病人CD8+T細胞顯著增高,使CD4/CD8比率顯著降低。用潑尼松治療期間因CD8+細胞顯著減少,使CD4/CD8比率顯著增高,伴隨血清HBV DNA水平增高;用IFNα治療期間因CD4‘細胞數增加,使CD4/CD8比率再次增高,伴隨血清HBV DNA水平降低。因而,激素停藥後CD8+細胞抑制後反跳,IFNα又促使CD4+細胞增殖,聯合治療可能是通過增強細胞免疫而獲得療效的。
(4)不良反應:可發生黃疽和症狀加重。肝失代償的發生率在反跳的病人中,部分非肝硬化病人較多發生臨床反跳,但肝硬化病人—旦發生臨床反跳,失代償的相對高危性是非硬化病人的16倍。