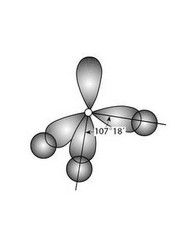
非極性鍵概念
 非極性鍵
非極性鍵在單質分子中,同種原子形成共價鍵,兩個原子吸引電子的能力相同,共用電子對不偏向任何一個原子,因此成鍵的原子都不顯電性。這樣的共價鍵叫做非極性共價鍵,簡稱非極性鍵。
 電子-模型圖
電子-模型圖  原子的組成粒子(含電子)-內部結構模型圖
原子的組成粒子(含電子)-內部結構模型圖 描述
由同種元素的原子間形成的共價鍵,叫做非極性共價鍵。同種原子吸引共用電子對的能力相等,成鍵電子對勻稱地分布在兩核之間,不偏向任何一個原子,成鍵的原子都不顯電性。非極性鍵可存在於單質分子中(如H2中H—H鍵、O2中O=O鍵、N2中N≡N鍵),也可以存在於化合物分子中(如C2H2中的C—C鍵)。非極性鍵的鍵偶極矩為0。以非極性鍵結合形成的分子都是非極性分子。存在於非極性分子中的鍵並非都是非極性鍵,如果一個多原子分子在空間結構上的正電荷幾何中心和負電荷幾何中心重合,那么即使它由極性鍵組成,那么它也是非極性分子。由非極性鍵結合形成的晶體可以是原子晶體,也可以是混合型晶體或分子晶體。例如,碳單質有三類同素異形體:依靠C—C非極性鍵可以形成正四面體骨架型金剛石(原子晶體)、層型石墨(混合型晶體),也可以形成球型碳分子富勒烯C60(分子晶體)。
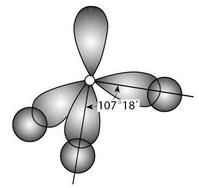 非極性鍵
非極性鍵極性鍵分子的形成極性鍵就是在2個元素之間的化學鍵.一般來說是每個原子提供一個電子來形成一個鍵.而形成極性的原因就是因為2個原子對電子吸引力不同.造成電子對偏向其中一個原子核.就會使偏向的那個原子帶正電.而另外的那個原子就帶負電。
例子
NH3結構是一個三角錐型的.每個N-H鍵之間的電性不能抵消.就是電子偏向N.而NH3的結構又不是對稱的.所以電性不能抵消.所以就是極性分子。
CO2..雖然C-O的電子對有偏向.但是因為CO2的結構是直線型的.所以是對稱的.所以偏向的電子的電性抵消掉了.從而形成非極性分子..
如果兩個原子所屬元素不同,電負性也就不同,那么形成的共價鍵的電子云就會向吸引電子能力強的方向偏移,這樣電負性大的一方帶有部分負電荷,電負性小的一方帶有部分正電荷,也就產生了負極和正極(這種東西在物理學中叫做偶極子),這種鍵稱為極性鍵。通常來說,兩種元素電負性差值越大,極性越強。衡量極性大小的物理量是偶極矩,是一個矢量,可以與一條有向線段一一對應。