形成原因
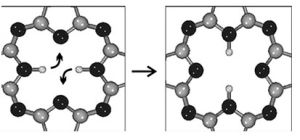 非共價鍵的形成
非共價鍵的形成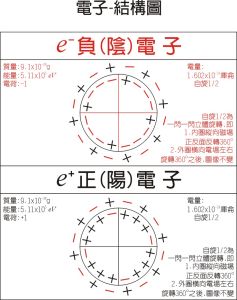 電子-模型圖
電子-模型圖 非極性分子
非 極性鍵可存在於 單質分子中(如H2中H—H鍵、O2中O=O鍵、N2中N≡N鍵),分子結構比較對稱的兩種 非金屬元素組成的 化合物也具有非極性共價鍵(如:BF3,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5等)。以非極性鍵結合形成的分子都是非極性分子。存在於非極性分子中的鍵並非都是 非極性鍵,如果一個多原子分子在空間結構上的正電荷幾何中心和負電荷幾何中心重合,那么即使它由極性鍵組成,那么它也是非極性分子。由非極性鍵結合形成的晶體可以是原子晶體,也可以是混合型晶體或分子晶體。例如,碳單質有三類同素異形體:依靠C—C非極性鍵可以形成正四面體骨架型金剛石( 原子晶體)、層型石墨( 混合型晶體),也可以形成球型碳分子富勒烯C60( 分子晶體)。