舉例
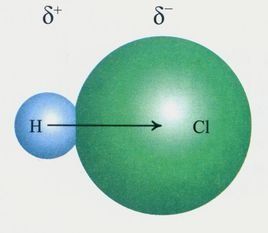 極性鍵說明
極性鍵說明HCl分子中的H-Cl鍵屬於極性鍵:HCl分子中,Cl的非金屬性比H強得多,所以電子明顯偏向Cl,Cl呈負
電性。
基本介紹
在化合物分子中不同種原子形成的共價鍵由於兩個原子吸引電子的能力不同共用電子對必然偏向吸引電子能力較強的原子一方因而吸引電子能力較弱的原子一方相對的顯正電性這樣的共價鍵叫做極性共價鍵簡稱極性鍵。
在單質分子中同種原子形成共價鍵兩個原子吸引電子的能力相同共用電子對不偏向任何一個原子因此成鍵的原子都不顯電性。這樣的共價鍵叫做非極性共價鍵簡稱非極性鍵。
形成原因
 氧氣分子
氧氣分子按照前線軌道理論去理解,極性鍵的形成原因可以這樣解釋。由於分子
軌道是由原子前線軌道線性組合而成。若A原子的電負性比B原子大,則其前線軌道能級比B原子前線軌道能級低。在形成共價鍵過程中,能量低的成鍵軌道(Bonding Orbital)的能級與先前的A原子前線軌道能級更接近,故此成鍵軌道主要由A原子的前線軌道構成;而能量較高的反鍵軌道(Anti-Bonding Orbital)能級則與原來的B原子前線軌道能級更接近,則其主要由B原子的前線軌道構成。由於電子優先分布於成鍵軌道,所以,電負性較大的A原子則占據了更多的電子,共價鍵的極性就這樣產生了。
形成條件
並不是只有非金屬元素之間才有可能形成極性共價鍵,金屬與非金屬之間也可以形成極性共價鍵(比如AlCl3,BeCl2等),一般來說,只要兩個非金屬原子間的電負性不同,且差距小於1.7,則形成極性鍵,大於1.7時,則形成離子鍵。
附註:極性鍵介於離子鍵和非極性鍵之間。
含有極性鍵的分子未必是極性分子,衡量極性分子的標準為偶極距的大小,只有當偶極距不為零時,分子才具有極性。
簡單來說,分子中,中心原子化合價的絕對值<>原子最外層電子數時,為極性分子。
以下為常見的極性分子:
極性分子:HX(x為鹵族元素),CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH
高中階段
高中階段知道以下的就夠了:
極性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH
非極性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油(混合物,嚴格來說不是)
簡單判斷依據
對於AnBm型 n=1 m>1,若A化合價的絕對值等於主族數,則為非極性。
