基本原理
廢水中的簡單氰化物和配合氰化物通過電解,在陽極和陰極上產生化學反應,把氰電解氧化為二氧化碳和氮氣。利用這一原理可有效去除廢水中的氰污染。
(1)在陽極產生的化學反應
對簡單氰化物,第一階段的反應是:
CN +2OH -2e→CNO +HO
反應進行得很劇烈,接著發生第二階段的兩個反應:
2CNO +4OH -6e→2CO↑+N↑+2HO
CNO +2HO→NH4 +3CN
電解過程中,產生一部分銨。
對配位氰化物,反應過程如下:(這裡以銅為例)
Cu(CN) +6OH -6e→Cu +3CNO +3HO
Cu(CN) →Cu +3CN
在電解的介質中投加食鹽時發生下列反應:
2Cl -2e→2[Cl]
2[Cl]+CN +2OH →CNO +2Cl +H2O
6[Cl]+Cu(CN) +6OH →Cu +3CNO +6Cl +3HO
6[Cl]+2CNO +4OH →2CO↑+N↑+6Cl +2HO
(2)在陰極產生的化學反應
2H +2e→H↑
Cu +2e→Cu
Cu +2OH-→Cu(OH)↓
工藝流程
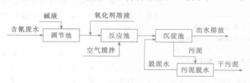 電解處理含氰廢水工藝
電解處理含氰廢水工藝含氰廢水電解處理以不溶性的石墨為陽極,鐵板為陰極,廢水中的氰根在直流電的作用下在陽極被氧化成無毒物質。含氰廢水電解處理的流程如圖所示。
電解處理含氰廢水產生的沉澱物,比電解處理含鉻廢水所產生的沉澱物要少得多,在廢水濃度較低及懸浮物較少的情況下,電解除氰後的水可不經沉澱和過濾而直接排放,不再設定沉澱池和污泥乾化場。當含鉻廢水和含氰廢水同時採用電解法處理時,兩種廢水處理可合併使用沉澱池和污泥乾化場。可見,含氰廢水電解處理設施和操作與含鉻廢水處理基本相同,僅是具體的工藝條件不同而已。
影響因素
(1)廢水的pH值
電解處理含氰廢水應在鹼性條件下進行,因為pH值偏低時,不利於氯對氰根的氧化,同時,由於陽極表面上存在著OH 的放電,導致陽極區的pH值下降,若pH值降至7以下,將會產生劇毒的氰氫酸氣體逸出,污染周圍環境。
若廢水的pH值偏高,在食鹽含量較低的情況下,陽極電流效率下降,除氰效果降低。一般pH值控制在9~10之間。
(2)食鹽添加量
含氰廢水的電導率較低,直接電解處理,槽電壓高、電流效率低、電能消耗大。投加食鹽的目的是增大廢水的導電率、降低槽電壓、減少電能的消耗。但是,如果食鹽投加量太多,不但會增加食鹽消耗費用,而且處理效率反而下降,所以食鹽的投加量不宜過多。一般在處理濃度較高的含氰廢水時,食鹽可多加一些,反之可少加一些。在處理含氰25~100mg/dm 濃度的廢水時,通常加入1~29/dm 食鹽。
(3)淨極距
電解處理含氰廢水用較厚的石墨作陽極,電解槽的陽極和陰極之間的距離常以表面間距即淨距離(稱淨極距)表示。當電流密度和食鹽投加量一定時,淨極距愈小,槽電壓愈低,處理效果愈好。當電解槽容積不變時,縮小淨極距,還可以提高陽極面積與有效水容積之比(即極水比)。所以,電解槽設計安裝要盡最大可能地減小淨極距,以提高極水比來降低槽電壓,以便提高處理效率和減少投資及處理費用。
(4)陽極電流密度
當食鹽加入量一定,按含氰廢水的氰化物濃度的高低決定採用電流密度的大小。濃度高,電流密度大;反之,電流密度小。
從經濟角度考慮,採用低電流密度和較長的電解時間較合算。對處理低濃度氰的廢水,在一般採用0.4~0.7A/dm 的陽極電流密度。
(5)空氣攪拌
為提高處理效率和防止沉澱物黏附在極板表面上或沉於槽底,電解槽需裝空氣攪拌。實踐證明,不攪拌將延長電解時間。攪拌的空氣量也不宜過大,否則,由於空氣的導電性差,使槽電壓增高。攪拌的空氣量以不使懸浮物沉澱為適度。
