產生
---------雙電層理論
德國化學家能斯特(H.W.Nernst)提出了雙電層理論(electron double layer theory)解釋電極電勢的產生的原因。當金屬放入溶液中時,一方面金屬晶體中處於熱運動的金屬離子在極性水分子的作用下,離開金屬表面進入溶液。金屬性質愈活潑,這種趨勢就愈大;另一方面溶液中的金屬離子,由於受到金屬表面電子的吸引,而在金屬表面沉積,溶液中金屬離子的濃度愈大,這種趨勢也愈大。在一定濃度的溶液中達到平衡後,在金屬和溶液兩相界面上形成了一個帶相反電荷的雙電層(electron double layer),雙電層的厚度雖然很小(約為10^-8厘米數量級), 但卻在金屬和溶液之間產生了電勢差。通常人們就把產生在金屬和鹽溶液之間的雙電層間的電勢差稱為金屬的電極電勢(electrode potential),並以此描述電極得失電子能力的相對強弱。電極電勢以符號E Mn+/ M表示, 單位為V(伏)。 如鋅的電極電勢以EZn2+/ Zn 表示, 銅的電極電勢以ECu2+/Cu 表示。
電極電勢的大小主要取決於電極的本性,並受溫度、介質和離子濃度等因素的影響。
標準電極
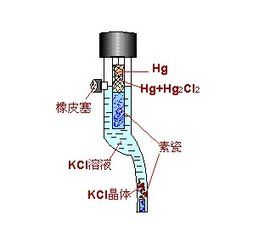
標準氫電極
電極符號: Pt|H2(101.3kPa)|H+(1mol.L-1)
電極反應: 2H+ + 2e = H2(g)
E⊖H+/ H2 = 0 V
右上角的符號“⊖”代表標準態。
標準態要求電極處於標準壓力(100kPa或1bar)下,組成電極的固體或液體物質都是純淨物質;氣體物質其分壓為100kPa;組成電對的有關離子(包括參與反應的介質)的濃度為1mol.L-1(嚴格的概念是活度)。通常測定的溫度為298K。
標準電極電勢
用標準氫電極和待測電極在標準狀態下組成電池,測得該電池的電動勢值,並通過直流電壓表確定電池的正負極,即可根據E池 = E(+)- E(-)計算各種電極的標準電極電勢的相對數值。
例如在298k,用電位計測得標準氫電極和標準Zn電極所組成的原電池的電動勢(E池)為0.76v,根據上式計算Zn2+/Zn電對的標準電極為-0.76v。用同樣的辦法可測得Cu2+/Cu電對的電極電勢為+0.34v。
電極的 E⊖為正值表示組成電極的氧化型物質,得電子的傾向大於標準氫電極中的H+,如銅電極中的 Cu2+;如電極的為負值,則組成電極的氧化型物質得電子的傾向小於標準氫電極中的H+,如鋅電極中的Zn2+。
實際套用中,常選用一些電極電勢較穩定電極如飽和甘汞電極和銀-氯化銀電極作為參比電極和其它待測電極構成電池,求得其它電極的電勢。飽和甘汞電極的電極電勢為0.24V。銀-氯化銀電極的電極電勢為0.22V。
標準電極電勢表
將不同氧化還原電對的標準電極電勢數值按照由小到大的順序排列,得到電極反應的標準電極電勢表。其特點有:
(l)一般採用電極反應的還原電勢,每一電極的電極反應均寫成還原反應形式,即:氧化型 + ne =還原型;
(2)標準電極電勢是平衡電勢,每個電對E⊖值的正負號,不隨電極反應進行的方向而改變。
(3)E⊖值的大小可用以判斷在標準狀態下電對中氧化型物質的氧化能力和還原型物質的還原能力的相對強弱,而與參與電極反應物質的數量無關。例如:
I2+2e =2I- E⊖= +0.5355V
1/2 I2+e = I- E⊖= +0.5355V
(4)E⊖值僅適合於標態時的水溶液時的電極反應。對於非水、高溫、固相反應,則有一定局限性。而對於非標態的反應可用Nernst方程轉化。
套用
(一)、判斷氧化劑和還原劑的相對強弱
在標準狀態下氧化劑和還原劑的相對強弱,可直接比較E⊖值的大小。
E⊖值越小(例如Li:-3.03v)的電極其還原型物質愈易失去電子,是愈強的還原劑,對應的氧化型物質則愈難得到電子,是愈弱的氧化劑。E⊖值愈大的電極其氧化型物質愈易得到電子,是較強的氧化劑,對應的還原型物質則愈難失去電子,是愈弱的還原劑。
[例1] 在下列電對中選擇出最強的氧化劑和最強的還原劑。並指出各氧化態物種的氧化能力和各還原態物種的還原能力強弱順序。
MnO4-/Mn2+、Cu2+/Cu、Fe3+ /Fe2+、I2/I-、Cl2/Cl-、Sn4+/Sn2+
(二)、判斷氧化還原反應的方向
1.根據E⊖值,判斷標準狀況下氧化還原反應進行的方向。
通常條件下,氧化還原反應總是由較強的氧化劑與還原劑向著生成較弱的氧化劑和還原劑方向進行。從電極電勢的數值來看,當氧化劑電對的電勢大於還原劑電對的電勢時,反應才可以進行。反應以“高電勢的氧化型氧化低電勢的還原型”的方向進行。在判斷氧化還原反應能否自發進行時,通常指的是正向反應。
2.根據電池電動勢E⊖池值,判斷氧化還原反應進行方向。
任何一個氧化還原反應,原則上都可以設計成原電池。利用原電池的電動勢可以判斷氧化還原反應進行的方向。由氧化還原反應組成的原電池,在標準狀態下,如果電池的標準電動勢 >0, 則電池反應能自發進行;如果電池的標準電動勢 <0, 則電池反應不能自發進行。在非標準狀態下,則用該狀態下的電動勢來判斷。
從原電池的電動勢與電極電勢之間的關係來看,只有 > 時,氧化還原反應才能自發地向正反應方向進行。也就是說,氧化劑所在電對的電極電勢必須大於還原劑所在電對的電極電勢,才能滿足E >0的條件。
從熱力學講電池電動勢是電池反應進行的推動力。當由氧化還原反應構成的電池的電動勢E⊖池大於零時,則此氧化還原反應就能自發進行。因此,電池電動勢也是判斷氧化還原反應能否進行的判據。
電池通過氧化還原反應產生電能,體系的自由能降低。在恆溫恆壓下,自由能的降低值(-△G)等於電池可能作出的最大有用電功(W電):
-△G=W電=QE=nFE池
即△G=-nFE池
在標準狀態下,上式可寫成:
△G⊖ = -nFE⊖池
當E⊖池 為正值時,△G⊖為負值,在標準狀態下氧化還原反應正向自發進行;當E⊖池為負值時,△G⊖為正值,在標準狀態下反應正向非自發進行,逆向反應自發進行。E或E⊖愈是較大的正值,氧化還原反應正向自發進行的傾向愈大。E池或E⊖池愈是較大的負值,逆向反應自發進行的傾向愈大。
[例2] 試判斷反應 Br2 + 2Fe2+ = 2Fe3+ + 2Br- 在標準狀態下進行的方向。
解:查表知:E⊖ Fe3+/Fe2+ = +0.77V
E⊖ Br/Br- = +1.07V
由反應式可知:Br 是氧化劑,Fe 是還原劑。
故上述電池反應的 = +1.07-0.77=0.29V>0
(三).判斷反應進行的限度
一個化學反應的完成程度可從該反應的平衡常數大小定量地判斷。因此,把標準平衡常數Kφ和熱力學吉布斯自由能聯繫起來。
△Gφ=-2.303RTlgKφ
△Gφ=-nFEφ
則: nFEφ = 2.303RTlgKφ
標準平衡常數Kφ和標準電動勢Eφ之間的關係式為:
nFEφ
lgKφ = ————————
2.303RT
R為氣體常數,T為絕對溫度,n為氧化還原反應方程中電子轉移數目,F為法拉第常數。
該式表明,在一定溫度下,氧化還原反應的平衡常數與標準電池電動勢有關,與反應物的濃度無關。Eφ越大,平衡常數就越大,反應進行越完全。因此,可以用Eφ值的大小來估計反應進行的程度。一般說,Eφ≥0.2~0.4V的氧化還原反應,其平衡常數均大於106( K>106 ),表明反應進行的程度已相當完全了。Kφ值大小可以說明反應進行的程度,但不能決定反應速率。
套用
大多數非金屬元素和過渡元素可以存在幾種氧化值,各氧化值之間都有相應的標準電極電勢。可將其各種氧化值按高到低(或低到高)的順序排列,在兩種氧化值之間用直線連線起來並在直線上標明相應電極反應的標準電極電勢值,以這樣的圖形表示某一元素各種氧化值之間電極電勢變化的關係圖稱為元素電勢圖,因是拉特默(Latimer)首創,故又稱為拉特默圖。根據溶液pH值的不同,又可以分為兩大類: (A表示酸性溶液)表示溶液的pH=0; (B表示鹼性溶液)表示溶液的pH=14。書寫某一元素的電勢圖時,既可以將全部氧化值列出,也可以根據需要列出其中的一部分。〖例如氯的元素電勢圖〗。
在元素電點陣圖的最右端是還原型物質,如Cl ,最左端是氧化型物質,如ClO 。中間的物質,相對於右端的物質是氧化型,相對於左端的物質是還原型,例如Cl 相對於Cl 是氧化型,相對於ClO 是還原型。
電勢圖概論
例:已知:φ(O2/H2O2) = 0.682V, φ(H2O2/H2O) = 1.77V,φ(O2/H2O) = 1.229V
元素電勢圖氧元素)
0 -1 -2
O2 0.682 H2O2 1.77 H2O
1.229
將元素不同氧化態,按氧化數由高到低順序排列成行;(與電對的表示相一致)
在兩物質間用直線連線表示一個電對;在直線上標明此電對的標準電極電勢。
電勢圖套用
從元素電勢圖可清楚看出某元素各氧化態的氧化還原性以及介質對氧化還原性的影響;
1.56 1.49
φθA ClO4— +1.19 ClO3— +1.21 HClO2 +1.64 HClO +1.63 Cl2 +1.36 Cl—
1.37 1.45
0.76 0.89
φθB ClO4— +0.36 ClO3— +0.33 ClO2— +0.66 ClO— +0.42 Cl2 +1.36 Cl—
0.52 0.62
φθA> 1V ;除φθ(Cl2/Cl—)外,φθB< 1V
∴氯的含氧酸作氧化劑時,應在酸性介質中進行;作還原劑時,應在鹼性介質中進行。
判斷歧化反應
元素的一種氧化態同時向較高和較低的氧化態轉化的過程稱為歧化反應。
例1: φθB ClO— 0.42 Cl2 1.36 Cl—
φθB
2ClO— + 2H2O + 2e =Cl2 + 4OH— 0.42
Cl2 + 2e =2Cl— 1.36
∴歧化反應能夠進行。
Cl2 + 2 OH— —→ ClO—+ Cl— + H2O
例2: Cu2+ 0.159 Cu+ 0.52 Cu
2 Cu+ —→ Cu2+ + Cu
∴φθ右﹥φθ左,歧化反應能夠自發進行。
逆反應判定
例3:φθA HClO 1.63 Cl2 1.36 Cl—
φθA
Cl2 + 2e =2Cl— 1.36
2HClO + 2H+ + 2e =Cl2 + 2H2O 1.63
HClO + Cl— + H+ —→ Cl2 + H2O
∴φθ左﹥φθ右,歧化反應的逆反應能夠自發進行。
即:
A B C
φθ左﹤φθ右,B —→A + C,歧化反應
φθ左﹥φθ右,A + C —→ B,歧化反應的逆反應
Sn4+ 0.154 Sn2+ -0.136 Sn
Sn4+ + Sn —→ 2Sn2+
Fe3+ 0.771 Fe2+ -0.44 Fe
2Fe3+ + Fe —→ 3Fe2+
用途
1.判斷歧化反應是否能夠進行
歧化反應即自身氧化還原反應:它是指在氧化還原反應中,氧化作用和還原作用是發生在同種分子內部同一氧化值的元素上,也就是說該元素的原子(或離子)同時被氧化和還原。
由某元素不同氧化值的三種物質所組成兩個電對,按其氧化值高低排列為從左至右氧化值降低。
假設B能發生歧化反應,那么這兩個電對所組成的電池電動勢:
B變成C是獲得電子的過程,應是電池的正極;B變成A是失去電子的過程,應是電池的負極,所以
= - > 0即 >
假設B不能發生歧化反應,同理:
= - < 0即 <
〖兩例歧化反應〗
由上兩例可推廣為一般規律:
在元素電勢圖 中,若 > ,物質B將自發地發生歧化反應,產物為A和C;若 < ,當溶液中有A和C存在時,將自發地發生歧化反應的逆反應,產物為B。
2.從已知電對求未知電對的標準電極電勢
假設有一元素的電勢圖:
根據標準自由能變化和電對的標準電極電勢關係:
ΔG = -n F
ΔG = -n F
ΔG = -n F
n 、n 、n 分別為相應電對的電子轉移數,其中n = n + n + n 則
ΔG = - n F = -(n + n + n ) F
按照蓋斯定律,吉布斯自由能是可以加合的,即:
ΔG = ΔG +ΔG +ΔG
於是整理得:-(n + n + n ) F = (- n F )+(- n F )+(- n F )
若有i個相鄰電對,則
根據此式,可以在元素電勢圖上,很直觀地計算出欲求電對的 值。
[例6-16] 已知298K時,氯元素在鹼性溶液中的電勢圖,試求出 [ClO /Cl ], [ClO /ClO ], [ClO /Cl ]的值。
解:298K時氯元素在鹼性溶液中的電勢圖
相關連線
1.微型科普 http://tieba.baidu.com/f?kz=842863410
2.PPT http://www.hfuu.edu.cn/zlgc/jpkc/wjhx/kejian/ch%2004%20%D1%F5%BB%AF%BB%B9%D4%AD%B7%B4%D3%A6/4.2%20%B5%E7%B9%85%B5%E7%CA%C6(40).ppt
3.搜搜 http://baike.soso.com/v364323.htm
4.豆丁網 http://www.docin.com/p-44400240.html
5.標準電極電勢表 http://chemlabs.nju.edu.cn/lab/content/FeKuang/yuxi3.htm