電勢-pH圖
正文
以電勢E為縱坐標,pH為橫坐標描繪元素-水系中各種反應的平衡條件圖。在濕法冶金的浸取過程和金屬腐蝕的研究中,經常套用這種圖。電勢-pH圖是在40年代末為比利時普巴(M.Pourbaix)所首創,有關文獻常稱為普巴(Pourbaix)圖。反應類型 元素-水系中發生的反應可分為兩類:
① 有電子得失的還原-氧化反應可表示為:
pOx+nH++ze qRed+cH2O (1)
qRed+cH2O (1)
式(1)所示半電池反應的平衡電極電勢E,可按涅斯特(Nernst)公式計算,即
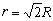
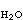 照例取為1;R為氣體常數,其數值是8.314焦/(摩·開);F為法拉第常數96490(庫侖/摩)。反應(1)的平衡條件描繪在電勢-pH圖上時,可得到斜率為
照例取為1;R為氣體常數,其數值是8.314焦/(摩·開);F為法拉第常數96490(庫侖/摩)。反應(1)的平衡條件描繪在電勢-pH圖上時,可得到斜率為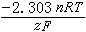 的一條直線,但此直線的位置只有在已知壓力、溫度以及aOX和aRed的條件下才能夠確定。所以,任何電勢-pH圖的繪製都以指定的壓力、溫度以及除H+以外的其他物質的活度條件為前提。
的一條直線,但此直線的位置只有在已知壓力、溫度以及aOX和aRed的條件下才能夠確定。所以,任何電勢-pH圖的繪製都以指定的壓力、溫度以及除H+以外的其他物質的活度條件為前提。 如果沒有H+參與半電池反應,則還原-氧化反應可寫成
pOx+ze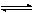 qRed (2)
qRed (2)
②無電子得失的非還原-氧化反應可表示為
aA+nH+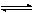 bB+cH2O (3)
bB+cH2O (3)
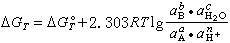
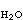 =1,於是
=1,於是 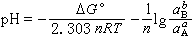
電勢-pH圖的構成和說明 將上述兩類共三種反應的平衡條件直線繪於一個圖上,便是電勢-pH圖。對反應(1)與(2)而言,若電勢高於其平衡電極電勢,則反應的平衡被破壞,反應向生成物質氧化態的方向移動,有利於物質氧化態的穩定存在。相反,若電勢低於反應的平衡電極電勢,則有利於物質還原態的穩定存在。也就是說,電勢-pH圖中斜線與水平線的上方為物質氧化態的穩定區(或優勢區),而下方為物質還原態的穩定區。同理,對反應(3)而言,若溶液的pH低於反應平衡pH,將有利於 B的穩定存在;相反,若溶液的pH高於反應平衡pH,則有利於A的穩定存在。因而,電勢-pH圖中垂直線以左的區域為B的穩定區,而以右的區域則為A的穩定區。可見,電勢-pH圖不僅以三種不同的線段反映了三種反應的平衡條件,而且由這些線段圍成的區域也反映了物質各種形態穩定存在或相對優勢的條件範圍。從這個意義上,有些文獻又稱此圖為物質優勢範圍圖或優勢區圖。
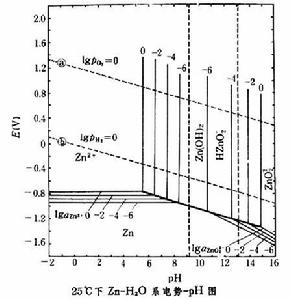
套用實例 作為水溶液反應熱力學分析的一種圖解法,電勢-pH圖有著重要的意義,已廣泛套用於金屬腐蝕與防腐、分析化學、地球化學以及濕法冶金等領域。下面舉25℃下Zn-H2O系電勢-pH圖為例說明它在濕法冶金中的套用。
圖中標示了離子Zn2+和ZnO娨的活度變化時,與這些離子有關的反應平衡條件的變動情況。圖中a,b兩條直線表示了下列兩種反應的平衡條件:
反應a. O2+4H++4e
 2H2O.
2H2O.E=1.229-0.0591pH+0.0148lgpO2
反應b.2H++2e
 H2
H2或 2H2O+2e
 H2+2OH-
H2+2OH-E=0-0.0591pH-0.0295lgpH2
圖中以 a和b兩條直線為界的區域是水的熱力學穩定區,因為若電勢與pH高於a線時水分解析出氧氣,而若電勢與pH低於b線時則水分解析出氫氣。此圖還說明,鋅既可在酸性溶液中以Zn2+形態存在,也可在鹼性溶液中以ZnO娨形態存在。從濕法冶金的角度來看,這一點說明既可用酸也可用鹼從含鋅物料中浸取鋅。圖中Zn2+穩定區相當大,Zn2+可以在接近中性的含酸溶液中穩定存在;這對鋅的濕法冶金也很有意義,說明鋅的浸取可在接近中性的溶液介質中進行,從而使某些易發生水解沉澱的雜質(例如Fe3+)在鋅浸取過程中不隨鋅一起進入溶液而留在浸取渣中。從圖還可以看到,若用電解法從含Zn2+溶液中提取金屬鋅,陰極電極電勢必須低於Zn2+穩定區與Zn穩定區的分界線,而在這樣低的電極電勢下,H2的析出在熱力學上是完全可能的;為了避免析出H2,以使鋅電解有效而經濟地進行,必須從動力學方面設法提高H2析出的超電勢。由於b線遠高於Zn2+與Zn的分界線,因而可以肯定,不可能用H2從硫酸鋅溶液中將Zn2+還原成金屬鋅。
 電勢-pH圖
電勢-pH圖參考書目
M.Pourbaix,Atlas d'equitibres electrochimiques,Gauthier-Villars, Paris,1963.