基本信息
在化學中,零級反應(zero-order reactions),是指反應速率與反應物濃度的零次方成正比(即與反應物濃度無關)的化學反應。即反應級數為0的化學反應。
定義
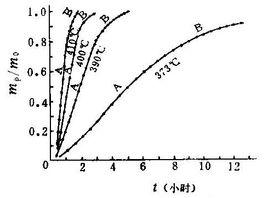
零級反應定義:指反應速率與反應物濃度的零次方成正比(即與反應物濃度無關)的化學反應。零級反應較少,一些發生在固體表面上的反應屬於零級反應。如氨在鎢、鐵等催化劑表面上的分解反應 。
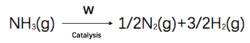 零級反應
零級反應說明
零級反應方程式
若對任何一個零級反應:A(g)——→ 產物,則-d[A]/dt=k [A] = k,即d[A]= -kdt,當t=0時,[A]=[A],當時間為t時,[A]=[A],兩邊積分,整理得,[A]=[A]-kt。
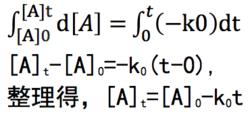 零級反應
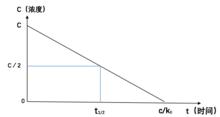
零級反應零級反應與時間的對應圖像
以零級反應的反應物濃度對時間t作圖,呈直線關係,其斜率為(-k)。
 零級反應
零級反應零級反應半衰期
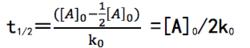 零級反應
零級反應當剩餘反應物為起始濃度的一半時,即[A]=[A]/2,反應的時間t稱為半衰期(half-life)。零級反應的半衰期與反應物的初始濃度成正比。
總結
光化反應與熱反應不同, 其活化能來源於特定波長的光能。吸收了一個光子的活化分子具有自己特殊的化學、物理性質並引起光化學過程。當反應物濃度足夠大, 使得活化分子一旦形成即可進一步反應時, 正向反應速度就取決於反應物的活化速度。根據愛因斯坦光化當量定律可知, 活化速度與吸收光強度成正比, 而對於反應物, 反應級數為零。因此, 在穩定光照條件下, 正反應為零級反應。而且, 在光化平衡條件下仍可保持這一動力學特徵。正由於光化反應的特殊性質, 使本反應在一定濃度範圍內平衡不隨濃度的改變而移動 。