極化現象與極化值
電鍍時對電極都要外加電流(通常為低壓直流電)。由於電沉積工件都是作為陰極,因而人們對陰極上發生的現象更為關心。
 陰極極化
陰極極化 陰極極化
陰極極化 陰極極化
陰極極化當對電極不外加電流時,用參比電極與被測電極組成一對電池(稱為原電池),測得的電池電動勢為電極的平衡電極電位,以 表示。當外加電流時,會發現再測電極電位時會有變化:陰極電位向負方向偏移,而陽極電位向正方向偏移。向負方向偏移,說明電極上有了過多的負電荷電子;向正方向偏移,說明電極上少了電子,積累有正電荷。這種通電時實際電位(以 表示)偏離了平衡電位的現象,就叫電極的“極化現象”。所偏離的數值即為“極化值”,以Δ 表示,則
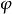 陰極極化
陰極極化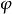 陰極極化
陰極極化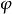 陰極極化
陰極極化Δ = -
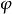 陰極極化
陰極極化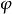 陰極極化
陰極極化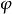 陰極極化
陰極極化電位向負方向偏移時,Δ 中為負值;向正方向偏移時,Δ 為正值。陰極上的電位向負方向偏移的現象叫“陰極極化”,Δ 為陰極極化值。陽極上的電位向正方向偏移,叫陽極極化,偏移值即為陽極極化值。
陰極極化產生原因
陰極上有電流通過時,電位向負方向移動,這種現象叫陰極極化。陰極極化有以下幾個原因:
1、活化極化(或電化學極化)
由於陰極還原反應需達到一定的活化能才能進行,使陰極還原反應速度小於電子進人陰極的速度,因而電子在陰極積累,結果使陰極電位向負方向移動,產生了陰極極化,這種陰極極化是由於陰極還原反應本身的遲緩性造成的,故稱為活化極化或電化學極化。
2、濃差極化
由於陰極附近反應物或反應產物擴散速度緩慢,可引起陰極濃差極化。例如,溶液中的氧或氫離子到達陰極的速度小於陰極反應本身的速度,造成陰極表面附近氧或氫離子的缺乏,結果產生濃差極化,使陰極電位變負。如果陰極反應產物(如OH )因擴散慢而積累在陰極表面附近,也會導致陰極濃差極化,使電位變負。
陰極極化表示陰極過程受到阻滯,使來自陽極的電子不能及時被吸收,因此阻礙金屬腐蝕的進行。反之,消除陰極極化的過程叫做陰極去極化。陰極去極化的作用,可使陽極過程順利進行,因此可維持或加速腐蝕過程。
提高陰極極化措施
一般說來,電化學極化作用對於改善鍍層質量起著很重要的作用,因此我們應儘可能想辦法通過提高陰極的電化學極化作用來提高鍍層的結晶細緻程度。同時,往往通過提高陰極極化度,還可提高鍍液的分散能力與深鍍能力。
在生產中,一般採取以下措施提高陰極極化作用:
(1)加入絡合劑。因為絡離子較簡單離子難於在陰極上還原,這就可使陰極積累較多的電子,從而使陰極極化值提高;
(2)加入添加劑。添加劑吸附在陰極表面上,可減慢金屬離子到達陰極表面的速度及金屬離子和電子反應的速度,從而提高陰極極化作用;
(3)提高陰極電流密度。在陰極極化作用隨陰極電流密度的增大而增大的情況下,可用提高陰極電流密度的辦法去提高陰極極化作用;
(4)適當降低電解液溫度。降低溫度能提高絡合劑的絡合能力,減慢金屬離子擴散到陰極表面的速度,從而提高陰極極化作用;
(5)加入導電鹽。在陰極極化度不為零的情況下,溶液導電性的提高可以促使電流在陰極表面更均勻地分布。
金屬電沉積過程陰極極化作用
電極在通電流以後,其電極電勢偏離平衡電勢的現象稱為電極的極化(作用)。金屬電極附近由於離子充放電引起濃度變化而產生的極化叫濃差極化;由放電一離子化步驟的遲緩性所引起的極化稱為電化學極化,描述帶電粒子通過相界面動力學規律性的理論,稱為遲緩放電理論。反應粒子在電極表面上或表面近鄰的液層中發生於氧化還原反應前的轉化步驟引起的極化,稱為轉化反應極化,例如簡單金屬離子水化程度的降低和重排、絡離子配位體的變換或配位數的降低等引起的極化。另外還有電結晶過程產生的極化。
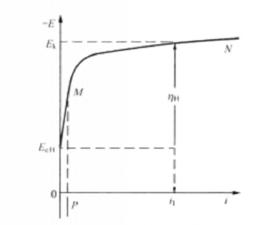
超電勢或過電位是極化電極電勢與平衡電極電勢之差值,為了使極化超電勢為正值,陰極極化超電勢η值等於陰極平衡電勢減陰極極化電勢(也稱析出電勢),即有:
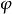 陰極極化
陰極極化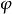 陰極極化
陰極極化η= -
陰極極化超電勢是上述各項極化超電勢的總和,各項極化超電勢對陰極極化超電勢的貢獻不是等同的,它與實際電極過程的特徵有關,例如大部分金屬以簡單離子形態在陰極電沉積時,濃差極化是電極過程的控制步驟,電極極化以濃差極化為主;而當金屬從其絡合物溶液中電沉積時卻以電化學極化為主,電化學反應過程是電極過程的控制步驟;另外有的電極過程是由這兩種極化聯合控制的等。電極極化作用影響電流效率、金屬電沉積的速度及金屬電沉積層的質量。電極極化作用增加了槽電壓,提高了電能消耗,因此對於化學電源、金屬電冶煉、電解精煉工業,極化作用是不利因素,應力求儘量減少。但是在電鍍工業中往往通過增加電極極化來改善金屬鍍層的質量,極化是一種需要創造的有利因素。