概述
 |
| 鑭系元素 |
電子構型
鑭系元素的外層和次外層的電子構型基本相同,電子逐一填充到4f軌道上。鑭系元素也屬於過渡元素,只是鑭系元素新增加的電子大都填入了從外側數第三個電子層(即4f電子層)中,所以鑭系元素又可以稱為4f系。為了區別於元素周期表中的d區過渡元素,故又將鑭系元素(及錒系元素)稱為內過渡元素。由於鑭系元素都是金屬,所以又可以和錒系元素統稱為f區金屬。鑭系元素原子基態的電子構型是4f0~145d0~16s2。來源
前四種錒系元素錒、釷、鏷、鈾存在於自然界。鎿至鐒11種錒系元素則全部用人工核反應合成(鎿、鈽在含鈾礦物中也有發現,但其量極微),合成的方式有在反應堆或核爆炸中輻照重元素靶及在加速器上用帶電粒子轟擊重元素靶等。爭論
鑥(Lu)是否屬於鑭系元素有爭論。最近的色譜分析顯示,鑥和鐒應屬於IIIB族,而非鑭系和錒系。但為了方便敘述,現今仍習慣將其與鑭系合稱。參見錒系元素中關於鐒的地位的爭論。性質
鑭系元素通常是銀白色有光澤的金屬,比較軟,有延展性並具有順磁性。鑭系元素的化學性質比較活潑。新切開的有光澤的金屬在空氣中迅速變暗,表面形成一層氧化膜,它並不緊密,會被進一步氧化,金屬加熱至200~400℃生成氧化物。金屬與冷水緩慢作用,與熱水反應劇烈,產生氫氣,溶於酸,不溶於鹼。金屬在200℃以上在鹵素中劇烈燃燒,在1000℃以上生成氮化物,在室溫時緩慢吸收氫,300℃時迅速生成氫化物。鑭系元素是比鋁還要活潑的強還原劑,在150~180℃著火。鑭系元素最外層(6S)的電子數不變,都是2。而鑭原子核有57個電荷,從鑭到鑥,核電荷增至71個,使原子半徑和離子半徑逐漸收縮,這種現象稱為鑭系收縮。由於鑭系收縮,這15種元素的化合物的性質很相似,氧化物和氫氧化物在水中溶解度較小、鹼性較強,氯化物、硝酸鹽、硫酸鹽易溶於水,草酸鹽、氟化物、碳酸鹽、磷酸鹽難溶於水。包括鑭、鈰、鐠、釹、鉕、釤、銪、釓、鋱、鏑、鈥、鉺、銩、鐿、鑥,它們都是稀土元素的成員。所有鑭系元素既能生成化學性質類似的三價化合物,個別鑭系元素也能生成比較穩定或不很穩定的四價或二價化合物,所以15個元素的化學性質並不完全相似,在光學、電磁學等物理性質也有較大的差別。氧化態
鑭系元素在固態、水溶液中或其他溶劑中的特徵氧化態是+3。由於鑭系元素在氣態時,失去兩個6s電子和一個5d電子或失去兩個6s電子和一個4f電子所需的電離能比較低,所以一般能形成穩定的+3氧化態。除+3特徵氧化態外,鑭系元素還存在著一些不常見的氧化態。例如:鈰、鐠、釹、鋱、鏑存在+4氧化態,原因是它們的4f層保持或接近全空、半滿或全充滿的狀態比較穩定,但只有+4氧化態的鈰能存在於溶液中,它是很強的氧化劑。同理,鈰、釹、釤、銪、銩、鐿還存在+2氧化態。原子半徑和離子半徑(鑭系收縮)
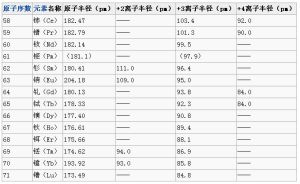 |
| 鑭系收縮 |
套用
鑭系元素套用極為廣泛。化學工業上主要用作催化劑。例如混合鑭系元素的氯化物和磷酸鹽用作催化劑,以加速石油的裂化分解。混合稀土氧化物廣泛用作玻璃拋光材料和玻璃的脫色劑,還可用來製造耐輻射玻璃和雷射玻璃。用三氧化二釔和三氧化二鏑可製得耐高溫透明陶瓷,這種陶瓷被用於火箭、雷射、電真空等技術工程上。此外,電視工業中大量使用的螢光粉為某些希土化合物,此螢光粉用於製造電視螢光屏。鋼鐵中加入少量稀土元素,可大大改善鋼的機械性能,因此希土元素可稱為鋼鐵的“維生素”。例如在生鐵里加進鈰,可得到球墨鑄鐵,使生鐵具有韌性且耐磨,可以鐵代鋼,以鑄代鍛。
此外,農業上用稀土元素可是糧食增產10%~20%,白菜增產29%,大豆增產50%,還可提高西瓜的產量和甜度,因此用作高效微量肥料。
