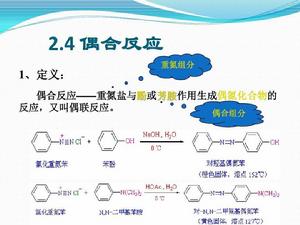
定義
芳香族胺發生重氮化反應生成重氮鹽,芳香族重氮鹽正離子可以作為親電試劑與酚、三級芳胺等活潑的芳香化合物進行芳環上的親電取代,生成偶氮化合物,通常把這種反應叫做重氮偶聯反應。
相關概念
重氮鹽
含有重氮基(-N≡N)的鹽類。乾燥的重氮鹽不穩定,受熱或震動易爆炸,但是也有例外,也就是所謂的穩定重氮鹽,例如氟硼酸重氮鹽,吡唑重氮內鹽以及三蝶烯重氮鹽。重氮鹽一般用芳香胺經重氮化製得。反應過程是把芳香胺加入到過量濃鹽酸(過量的酸的作用是防止生成的重氮鹽與沒有反應的芳香胺偶聯,生成偶氮化合物)中,再加入適量亞硝酸鈉溶液(整個反應過程需控制在0~5℃),用碘化鉀澱粉試紙檢驗亞硝酸鈉是否過量(不足需補加,過量加尿素破壞)。脂肪胺的重氮鹽極不穩定,在生成的過程中就會分解,生成醇(分解過程中經過碳正離子,會有重排現象)。
芳香族重氮鹽可以發生多種偶聯反應。例如:芳香重氮鹽中的苯基在鹼性條件下與其他芳香族化合物偶聯成聯苯衍生物;芳香重氮鹽在酸性溶液中用銅粉或鋅粉處理,或在鹼性溶液中用亞銅鹽處理時,放出氮氣,兩個芳基偶聯成聯苯衍生物;一些芳香重氮鹽在鹼性條件下發生分子內的偶聯生成雜環化合物;芳香重氮鹽與具有活潑亞甲基的化合物在鹼性溶液中偶聯生成芳脈。重氮偶聯反應在有機合成中特別是在染料的合成中,套用較廣。重氮鹽與酚、芳香族胺的偶聯製取偶氮化合物,是合成偶氮染料的基礎。
芳香族偶氮化合物
偶氮化合物即AZO,偶氮基─N=N─與兩個烴基相連線而生成的化合物,通式R─N=N─R′。
芳香族偶氮化合物共軛體系進一步增大,並且具有較高的化學穩定性和熱穩定性,良好的光學性能和溶解性。芳香偶氮化合物通常以比較穩定的反式結構存在,在適當的波長的紫外光照射下, 反式結構會逐漸轉變成順式結構,在可見光的照射下,順式結構又可恢復到反式結構。這些特點使得芳香偶氮化合物作為一種重要的化合物中間體,被廣泛地套用於有機染料、生物醫藥、食品添加劑、自由基誘發劑、液晶材料及非線性光學材料等許多領域。偶氮化合物是一類有顏色的化合物,有些可直接作染料或指示劑。
偶聯反應
偶聯反應為是2A-B→A-A類型的反應。是由兩個有機化學單位進行某種化學反應而得到一個有機分子的過程。偶聯反應具有多種途徑,在有機合成中套用比較廣泛。胺基酸結合而成蛋白質的反應也是偶聯反應。在有機分析中,常利用偶聯反應產生的顏色來鑑定具有苯酚或芳胺結構的藥物。
反應分類
Suzuki反應
是過渡金屬鈀或鎳催化的偶聯反應,一直是合成aryl-aryl 鍵最有效的方法之一。在過渡金屬催化的芳基偶聯反應中,在四個三苯基膦配體配合的鈀催化下,芳基硼酸與溴或碘代芳烴的交叉偶聯反應被稱為芳基偶聯反應。Suzuki 偶聯反應的催化循環過程通常認為先是Pd(0)與鹵代芳烴發生氧化-加成反應生成Pd(II)的絡合物,然後發生金屬轉移反應生成Pd(II)的絡合物,最後進行還原-消除而生成產物和Pd(0)。
鹵代芳烴與氧化加成後,與等當量的鹼生成有機鈀氫氧化物中間物種,取代了鍵極性相對弱的Pd-X鍵,這種含強極性鍵Pd一O的中間物種具有較強的親電性另一當量的鹼與芳基硼酸生成四價硼酸鹽中間物種,具有較強的富電性,有利於陰離子向Ar'一Pd一OH的金屬中心遷移。由這兩方面協同作用形成的有機鈀絡合物Ar一Pd一Ar',經還原消除生成芳基偶聯產物。有研究發現,在溴代芳烴的偶聯反應中,速率決定步驟在於氧化加成,而在碘代芳烴的偶聯反應中,芳基陰離子向金屬中心遷移過程是速率決定步驟。
Heck反應
Heck 反應是一類重要的鹵代芳烴烯基化、形成新的C—C 鍵的合成反應,1972年由Heck發現,近幾年來一直是催化化學和有機化學的研究熱點。Heck反應是由一個不飽和鹵代烴(或三氟甲磺酸鹽)和一個烯烴在鹼和鈀催化下生成取代烯烴的一個反應。催化劑主要有氯化鈀,醋酸鈀,三苯基膦鈀,CuI等;載體主要有三苯基膦,BINAP等;所用的鹼主要有三乙胺,碳酸鉀,醋酸鈉等。溶劑以DMF、NMP等極性非質子溶劑為主。
Stille偶聯反應
Stille反應是有機錫化合物和不含β-氫的鹵代烴(或三氟甲磺酸酯)在鈀催化下發生的交叉偶聯反應。
該反應由Stille等於20世紀70年代首先發現,[是有機合成中很重要的一個偶聯反應,總數占到當下所有交叉偶聯反應的一半以上。該反應一般在無水無氧溶劑及惰性環境中進行。等當量的Cu(I)或Mn(II)鹽可以提高反應的專一性及反應速率。氧氣會使鈀催化劑發生氧化,並導致有機錫化合物發生自身偶聯。四(三苯基膦)合鈀(0)是最常用的催化劑,其他催化劑包括PdCl(PPh)、PdCl(MeCN)等。
使用的鹵代烴一般為氯、溴、碘代烴,以及乙烯基或芳基三氟甲磺酸酯。用三氟甲磺酸酯時,加入少量的氯化鋰可以活化氧化加成一步的產物,使反應速率加快。烴基三丁基錫是最常用的有機錫原料。雖然烴基三甲基錫的反應性更強,但較大的毒性(約前者的1000倍)限制了其套用。強極性溶劑(如六甲基磷醯胺、二甲基甲醯胺或二惡烷)可以提高有機錫原料的活性。
該反應歷程為:活性零價鈀與鹵代烴發生氧化加成反應,生成順式的中間體,並很快異構化生成反式的異構體。後者與有機錫化合物發生金屬交換反應,然後發生還原消除反應,生成零價鈀及反應產物,完成一個催化循環。錫所連基團發生金屬交換一步時的速率有如下順序:
炔基 > 烯基 > 芳基 > 烯丙基 ~ 苄基 > α-烷氧基烴基 > 烴基
Negishi偶聯反應
Negishi反應是一類由Ni或Pd催化的有機鋅試劑與鹵代烴間的偶聯反應,適用於製備不對稱的二芳基、二芳基甲烷、苯乙烯型或苯乙炔型化合物。鹵代雜環芳烴也可以進行類似的反應。
注意事項
進行偶聯反應時,介質的酸鹼性是很重要的。一般重氮鹽與酚類的偶聯反應,是在弱鹼性介質中進行的。在此條件下,酚形成苯氧負離子,使芳環電子云密度增加,有利於偶聯反應的進行。重氮鹽與芳胺的偶聯反應,是在中性或弱酸性介質中進行的。在此條件下,芳胺形成銨鹽而增大了溶解度,成鹽反應是可逆的,隨著偶聯反應中芳胺的消耗,芳胺的鹽會重新轉換成芳胺而滿足反應的需要。如果溶液酸性過強,胺變成了銨鹽,使芳胺濃度降低,使得偶聯反應減弱或中止。如果從重氮鹽的性質來看,強鹼性介質會使重氮鹽轉變成不能進行偶聯反應的其它化合物。