還原型
還原 huányuán
①[returntotheoriginalconditionorshape;restore]事物恢復到原來的狀況或形狀
②[reduction]用化學或電化學方法引起的以下的作用或過程:除去非金屬元素以產生金屬;從某物質除去氧;與氫化合或受氫作用;用降低電負性部分的比例改變某種化合物;改變某種元素或離子從較高的氧化態至較低的氧化態;加一個或幾個電子到一個原子、離子或分子
鐵礦石的還原是通過燃燒焦炭產生的一氧化碳而得以實現
血紅蛋白
目錄
概述
工作原理
生理意義
正常參考值
異常結果分析
haemoglobin;hemoglobin;ferrohemoglobin;Hb;HHb
概述
血紅蛋白是高等生物體內負責運載氧的一種蛋白質。
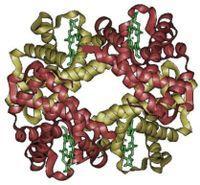
分子結構:每一血紅蛋白分子由一分子的珠蛋白和四分子亞鐵血紅素組成,珠蛋白約占96%,血紅素占4%。
人體內的血紅蛋白由四個亞基構成,分別為兩個α亞基和兩個β亞基,在與人體環境相似的電解質溶液中血紅蛋白的四個亞基可以自動組裝成α2β2的形態。
血紅蛋白的每個亞基由一條肽鏈和一個血紅素分子構成,肽鏈在生理條件下會盤繞摺疊成球形,把血紅素分子抱在裡面,這條肽鏈盤繞成的球形結構又被稱為珠蛋白。血紅素分子是一個具有卟啉結構的小分子,在卟啉分子中心,由卟啉中四個吡咯環上的氮原子與一個亞鐵離子配位結合,珠蛋白肽鏈中第8位的一個組氨酸殘基中的吲哚側鏈上的氮原子從卟啉分子平面的上方與亞鐵離子配位結合,當血紅蛋白不與氧結合的時候,有一個水分子從卟啉環下方與亞鐵離子配位結合,而當血紅蛋白載氧的時候,就由氧分子頂替水的位置。
血紅蛋白是脊椎動物紅血細胞的一種含鐵的複合變構蛋白,由血紅素和珠蛋白結合而成。其功能是運輸氧和二氧化碳,維持血液酸鹼平衡。也存在於某些低等動物和豆科植物根瘤中。分子量約67000,含有四條多肽鏈,每個多肽鏈含有一個血紅素基團,血紅素中鐵為二價,與氧結合時,其化學價不變,形成氧合血紅蛋白。呈鮮紅色,與氧解離後帶有淡藍色。有多種類型:血紅蛋白A(HbA),α2β2,占成人血紅蛋白的98%;血紅蛋白A2(HbA2),α2δ2,占成人血紅蛋白的2%;血紅蛋白F(HbF),α2γ2,僅存在於胎兒血中;血紅蛋白H(HbH),β4,四個相同β鏈組成的四聚體血紅蛋白;血紅蛋白C(HbC),β鏈中Lys被Glu取代的血紅蛋白;血紅蛋白S(HbS),鐮刀狀細胞紅蛋白;血紅蛋白O2(HbO2,HHbO2),氧合血紅蛋白;血紅蛋白CO(HbCO),一氧化碳結合血紅蛋白。在沒有氧存在的情況下,四個亞基之間相互作用的力很強。氧分子越多與血紅蛋白結合力越強。中心離子鐵(II)進一步和蛋白質鏈中的組氨酸結合,成為五配位。既是配位中心,又是活性中心。血紅蛋白中鐵(II)能可逆地結合氧分子,取決於氧分壓。它能從氧分壓較高的肺泡中攝取氧,並隨著血液循環把氧氣釋放到氧分壓較低的組織中去,從而起到輸氧作用。一氧化碳與血紅蛋白的結合較氧強,即使濃度很低也能優先和血紅蛋白結合,致使通往組織的氧氣流中斷,造成一氧化碳中毒。
工作原理
血紅蛋白與氧結合的過程是一個非常神奇的過程。首先一個氧分子與血紅蛋白四個亞基中的一個結合,與氧結合之後的珠蛋白結構發生變化,造成整個血紅蛋白結構的變化,這種變化使得第二個氧分子相比於第一個氧分子更容易尋找血紅蛋白的另一個亞基結合,而它的結合會進一步促進第三個氧分子的結合,以此類推直到構成血紅蛋白的四個亞基分別與四個氧分子結合。而在組織內釋放氧的過程也是這樣,一個氧分子的離去會刺激另一個的離去,直到完全釋放所有的氧分子,這種有趣的現象稱為協同效應。
血紅素分子結構由於協同效應,血紅蛋白與氧氣的結合曲線呈S形,在特定範圍內隨著環境中氧含量的變化,血紅蛋白與氧分子的結合率有一個劇烈變化的過程,生物體內組織中的氧濃度和肺組織中的氧濃度恰好位於這一突變的兩側,因而在肺組織,血紅蛋白可以充分地與氧結合,在體內其他部分則可以充分地釋放所攜帶的氧分子。可是當環境中的氧氣含量很高或者很低的時候,血紅蛋白的氧結合曲線非常平緩,氧氣濃度巨大的波動也很難使血紅蛋白與氧氣的結合率發生顯著變化,因此健康人即使呼吸純氧,血液運載氧的能力也不會有顯著的提高,從這個角度講,對健康人而言吸氧的所產生心理暗示要遠遠大於其生理作用。
除了運載氧,血紅蛋白還可以與二氧化碳、一氧化碳、氰離子結合,結合的方式也與氧完全一樣,所不同的只是結合的牢固程度,一氧化碳、氰離子一旦和血紅蛋白結合就很難離開,這就是煤氣中毒和氰化物中毒的原理,遇到這種情況可以使用其他與這些物質結合能力更強的物質來解毒,比如一氧化碳中毒可以用靜脈注射亞甲基藍的方法來救治。