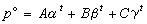蒸氣壓方程
在一定溫度下,液態和固態的純物質都有相應的飽和蒸氣壓。當溫度升高時,飽和蒸氣壓大體呈指數關係上升。採用僅含少量參數的蒸氣壓方程關聯飽和蒸氣壓與溫度數據,可以概括大量實驗信息。這樣便於數據的收集、貯存和取用。飽和蒸氣壓是重要的化工基礎數據,常用於標準態逸度、蒸發熱、升華熱(見熱化學數據)及相平衡關聯等方面的計算。早期的蒸氣壓方程有1794年提出的普羅尼方程:
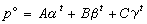

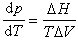
在用於汽液或汽固相變化時,對ΔH/ΔV 作不同的簡化,可以得到不同的蒸氣壓方程,常用的有:
①克拉珀龍方程 由克拉珀龍提出:
lnp°=A-B/T
式中A和B為特徵參數。這是最簡單的蒸氣壓方程,適用於溫度遠低於臨界溫度的場合;但在用於正常沸點(101.325kPa下的沸點)以下時,計算值通常偏高,且一般不適用於締合液體 (如醇類)。將此方程用臨界溫度Tc(此時飽和蒸氣壓為臨界壓力pc) 和正常沸點Tb(此時飽和蒸氣壓為101.325kPa)消去A和B,可得到普遍化蒸氣壓方程: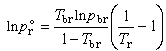
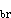 =101.325/pc;T
=101.325/pc;T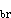 =Tb/Tc(見對應態原理)。為了提高計算準確度,可引入第三參數偏心因子ω,得:
=Tb/Tc(見對應態原理)。為了提高計算準確度,可引入第三參數偏心因子ω,得: lnp嬼=f【0】(Tr)+ωf【1】(Tr)
式中f【0】和f【1】為Tr的普適函式。在Tb到Tc範圍內,該式誤差通常在1%~2%之內;在溫度低於Tb時,計算值可能偏低百分之幾。②安托因方程 由C.安托因提出:
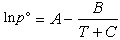
蒸氣壓方程中,蒸氣壓僅是溫度的單變數函式,因而只適用於不存在表面張力、流體靜壓力、重力和電磁場等的影響時。一般在化工計算中,上述影響可不考慮。但當液體表面曲率不容忽略時(如蒸氣冷凝形成液滴時),就要考慮表面張力的影響。當流體靜壓力較大時(如液面有高壓惰性氣體作用時),也要考慮壓力的影響。