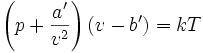范德瓦耳斯方程
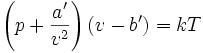 范德瓦耳斯方程
范德瓦耳斯方程相關條目
【1】范氏方程是對理想氣體狀態方程的一種改進,特點在於將被理想氣體模型所忽略的的氣體分子自身大小和分子之間的相互作用力考慮進來,以便更好地描述氣體的巨觀物理性質。
目錄 【隱藏】
1 方程的形式
2 適用範圍
3 方程的提出
4 與理想氣體方程模擬結果的比較
4.1 低壓狀況
4.2 中高壓狀況
5 用范氏方程描述氣體的液化
6 其他熱力學參量
7 簡化形式
8 在可壓縮流動中的套用
9 注釋
10 參考資料
11 參見
12 外部連結
【編輯】 方程的形式
范德瓦耳斯方程具體形式為
更常用的形式為 (N=摩爾數)
式中
p 為氣體的壓強
a' 為度量分子間引力的唯象參數
b' 為單個分子本身包含的體積
v 為每個分子平均占有的空間大小(即氣體的體積除以總分子數量);
k 為玻爾茲曼常數
T 絕對溫度
在第二個方程里
V 為總體積
a 為度量分子間引力的參數
b 為1摩爾分子本身包含的體積之和 b = NAb',
R 為普適氣體常數
NA 為阿伏加德羅常數.
下表列出了部分氣體的a,b 的值
氣體種類 a 【kPa (dm³/mol)²】 b 【dm³】
氦氣(He) 3.45 0.024
氫氣(H2) 24.32 0.027
氮氣(N2) 141.86 0.039
氧氣(O2) 137.80 0.032
二氧化碳(CO2) 364.77 0.043
水蒸氣(H2O) 557.29 0.031
在上述方程中必須嚴格區分總體平均性質和單個分子的性質。譬如,第一個方程中的v 是每個分子平均占有空間的大小(可以理解成分子平均“勢力範圍”的大小),而b' 則為單個分子本身“包含”的體積(若為單原子分子如稀有氣體,b '就是原子半徑內包含的體積)。
【編輯】 適用範圍
范氏方程對氣-液臨界溫度以上流體性質的描寫優於理想氣體方程。對溫度稍低於臨界溫度的液體和低壓氣體也有較合理的描述。
但是,當描述對象處於狀態參量空間(P,V,T)中氣液相變區(即正在發生氣液轉變)時,對於固定的溫度,氣相的壓強恆為所在溫度下的飽和蒸氣壓,即不再隨體積V(嚴格地說應該是單位質量氣體占用的體積,即比容)變化而變化,所以這種情況下范氏方程不再適用。
【編輯】 方程的提出
水分子之間的范氏引力(中國大陸的中學教科書稱為“范德瓦耳斯力”或“范德華力”)
一個雙原子分子的排斥體積(圖中黑色的部分)下面以理想氣體狀態方程為基礎,推導范氏方程。若把氣體視為由體積無限小、相互之間無作用力的分子組成,這種模型便是理想氣體模型,與其相對應的狀態方程是:
若拋棄前一個的假設,把組成氣體的分子視為有一定大小的剛性球(其半徑稱為范德瓦爾斯半徑),用b 表示這些“球”的體積,上面的方程便改寫為:
在這裡,每個分子的“占有體積”v 被所謂“排斥體積”v - b 代替,反映了分子在空間中不能重疊。若氣體被壓縮至體積接近分子體積之和(即分子間空隙v - b 趨向於0),那么其壓強將趨於無窮大。
下一步,我們考慮原子對之間的引力。引力的存在會使分子的平均亥姆霍茲自由能下降,減少量正比於流體的密度。但壓強的大小滿足熱力學關係
式中A* 為每個分子的亥姆霍茲自由能。由此得到,引力使壓強減小的量正比於1/v²。記該比例常數為a,可得
這便是范氏方程。
【編輯】 與理想氣體方程模擬結果的比較
【編輯】 低壓狀況
在氣體壓強不太高的情況下,以下事實成立:
排斥體積b 的影響相對V 而言極小,可以忽略;以二氧化碳(CO2)為例,在標準狀況(0°C,1標準大氣壓)下,一摩爾CO2體積V 為 22414 cm³,而相應的b= 43 cm³,比V 小3個數量級;
分子間的距離足夠大,a/V² 項完全可以視為0;譬如在一大氣壓下二氧化碳氣體的a/V² 值只有7‰。
所以此時理想氣體方程是范氏方程(也是對實際氣體行為的)的一個良好近似。
分別用理想氣體方程和范德瓦耳斯方程模擬的二氧化碳氣體70°C時的p-V等溫線
【編輯】 中高壓狀況
隨著氣體壓力的增加,范氏方程和理想氣體方程結果的差別會變得十分明顯(左圖為CO2分別用理想氣體方程和范德瓦耳斯方程模擬的p-V等溫線,溫度70°C):
在壓強為5000~15000kPa(50~150標準大氣壓)的中壓區,由於體積被“壓小”導致分子間距靠近,分子間的引力(表現為a/V² 項)變得不可忽略。a/V² 項的存在使得氣體的壓強比不考慮分子間引力的理想氣體模型估計結果要小(所以左圖的中壓區里紅線比藍線要低)。
在壓強為15000kPa以上的高壓區,體積的急劇壓縮致使b 的影響不可忽略,於是范氏方程中的體積項V-Nb(或比容項v-b)將比理想氣體方程中的體積項要小(或者說:對應相同體積/比容值的壓強項會升高)。這一效應導致在高壓區范氏氣體的狀態線重新趕上並超過理想氣體線(見左圖的左上角)。
【編輯】 用范氏方程描述氣體的液化
范氏方程適用於氣體的液化過程。氣體液化可能發生的最高溫度稱為臨界溫度,用TC表示:
當溫度T>TC時,無論給氣體施加多大的壓強都無法將它液化;
當溫度T<TC時,氣體可在壓強大於一定值時液化,且這一壓強隨著溫度T 下降而下降;
用范德瓦耳斯方程模擬的二氧化碳氣體不同溫度下壓縮過程的p-V等溫線,在臨界溫度以下時能看見明顯的液化過程右圖所示為用范氏方程模擬的CO2在不同溫度下的p-V 等溫線,從中可以明顯看出范氏方程對液化過程的模擬(注意:若用理想氣體狀態方程作上述模擬,得到的只是一系列雙曲線,因為在等溫條件下理想氣體狀態方程就退化為玻意耳-馬略特定律——pV=常數)。CO2氣體的臨界溫度為TC=31°C = 304 K。
70°C 時的曲線(右圖中藍線)形狀仍與玻意耳定律的結果(雙曲線)類似,儘管位置要略低;
當溫度下降到40°C,曲線(右圖中右二的曲線)形狀發生明顯的變化,表現為兩個拐點的出現。但此時二氧化碳仍然以氣態存在;
溫度進一步降至臨界溫度31°C(圖中紅線),若此時氣體受壓至體積小於某定值VC(隨溫度變化而變化),則氣體將發生液化。圖中V>VC 時曲線對應氣態CO2的p,V 值,V<VC 時曲線對應液態CO2的p,V 值;
圖中13°C 和 21°C 對應的曲線只有兩拐點以外的部分是與物理實際相符的。當氣體被進一步壓縮至比右拐點對應體積更小時,氣體將進入液化區,在液化過程中實際氣體的p-V線應是一段“平台”,而不是如圖所示的“駝峰”型。但完全液化後,液態CO2的壓強卻仍能被圖中曲線恰當地反映,此時曲線隨體積的減小而劇烈上升,這一定程度上反映了液體的不可壓縮性。另外,我們從圖中能得到的另一個信息就是“液化平台”的長度隨溫度的下降而增加;
氣體的臨界狀態參量VC、pC、TC和范德瓦爾斯常數a、b之間存在下列數學關係:
我們可以利用這些關係通過測出氣體的TC和對應的pC來得到a 和b 的值(由於測量上的困難,一般不使用VC)。
【編輯】 其他熱力學參量
下面,我們不再考慮v=V/N (N為系統中的分子數),改為考慮總體體積V 。
狀態方程並不能告訴我們系統的所有熱力學參量。我們可以照搬上面推導范氏方程的思路,從理想氣體的亥姆霍茲自由能表達式出發,推得下面的結論:
式中A 為亥姆霍茲自由能,是無量綱的定容熱容,Φ是待定的熵常數。上述方程將A 用它的自然變數V 和T 表示【2】,所以系統的所有熱力學信息已全部知道。其力學狀態方程就是前面導出的范氏方程
系統的熵(S )由下式決定
綜合A 和S 的表達式,可由定義得到系統內能
其他熱力學勢和化學勢也可用類似的方程給出,但任何勢函式若要用壓強P 表示都需要求解一個三階多項式,使結果的形式變得很繁雜。所以,將焓和吉布斯自由能用它們相應的自然變數表示的結果都是複雜的(因為P 是它們的自然變數之一)。
【編輯】 簡化形式
雖然在一般形式的范氏方程中,常數a和b 因氣體/流體種類而異,但我們可以通過改變方程的形式,得到一種適用於所有氣體/流體的普適形式。
按照下面的方式定義約減變數(亦稱折合變數,就是把變數轉換成其無量綱形式),其中下標R 表示約減變數,下標C 表示原變數的臨界值:
,
,
,
式中,,。
用約減變數代替原變數,范氏方程形式變為
這就是范氏方程的不變形式,即這一形式不會因套用流體種類改變而改變。
上述方程的不變性質亦稱對應態原理。
【編輯】 在可壓縮流動中的套用
在流體力學中,范氏方程可以作為可壓縮流體(如液態高分子材料)的PVT狀態方程。這種情況下,由於比容V 變化不大,可將方程簡化為:
,
其中p 為壓強,V 為比容,T 為溫度,A、B、C 均為與對象相關的參數。
【編輯】 注釋
↑ 嚴格地說,范氏方程也適用於某些狀態下的液體,但常用的還是在氣體中,參見適用範圍
↑ 亥姆霍茲自由能A 是一個特性函式,它作為溫度T 和體積V 的全微分表達式為 dA = -SdT-PDV,參見熱力學勢函式。
【編輯】 參考資料
趙凱華、羅蔚茵著,《新概念物理教程·熱學》(第二版),高等教育出版社,北京,2005,ISBN 7-04-017680-7
汪志誠編,《熱力學·統計物理》(第二版),高等教育出版社,北京,1993,ISBN 7-04-004360-2