成份
 舒普深
舒普深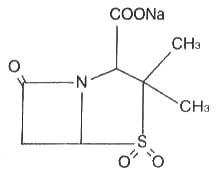 舒普深
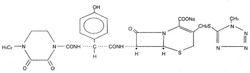
舒普深本品為複方製劑,其組份為頭孢哌酮鈉和舒巴坦鈉(頭孢哌酮與舒巴坦為2:1)。
頭孢哌酮鈉的化學名稱為:(6R,7R)-3-[[(1-甲基-1H-四唑-5-基)硫]甲基]-7-[(R)-2-(4-乙基-2,3-二氧代-1-哌嗪碳醯氨基)-2-對羥基苯基-乙醯氨基]-8-氧代-5-硫雜-1-氮雜雙環[4.2.0]辛-2-烯-2-甲酸鈉,化學結構式:
分子式:CHNNaOS
分子量:667.65
舒巴坦鈉的化學名稱為:(2S,5R)-3,3-二甲基-7氧代-4-硫雜-1-氮雜雙環[3.2.0]庚烷-2-羧酸鈉-4,4-二氧化物,化學結構式:
分子式:CHNNaOS
分子量:255.22
性狀
本品為白色或類白色粉末。
適應症
[u]單獨套用本品適用於治療由敏感細菌所引起的下列感染[/u]:
上、下呼吸道感染;
上、下泌尿道感染;
腹膜炎、膽囊炎、膽管炎和其他腹腔內感染;
敗血症;
腦膜炎;
皮膚和軟組織感染;
骨骼和關節感染;
盆腔炎、子宮內膜炎、淋病和其他生殖系統感染。
[u]聯合用藥[/u]:
由於本品具有廣譜抗菌活性,因此單用本品就能夠治療大多數感染,但有時也需要本品與其他抗生素聯合套用。當本品與氨基糖苷類抗生素合用時(參見【注意事項】[u]配伍禁忌[/u]氨基糖苷類抗生素部分),在治療過程中應監測患者的腎功能(參見【用法用量】[u]腎功能障礙患者的用藥[/u]部分)。
規格
1.5克(以頭孢哌酮計1000毫克與以舒巴坦計500毫克);
3.0克(以頭孢哌酮計2000毫克與以舒巴坦計1000毫克)。
用法用量
[u]成人用藥[/u]:
本品成人每日推薦劑量如下:
比例 頭孢哌酮/舒巴坦(g) 頭孢哌酮(g) 舒巴坦(g)
2:1 1.5-3.0 1.0-2.0 0.5-1.0
上述劑量分等量,每12小時給藥一次。在治療嚴重感染或難治性感染時,本品的每日劑量可增加到12g(2:1頭孢哌酮/舒巴坦,即頭孢哌酮8g,舒巴坦4g)。舒巴坦每日推薦最大劑量為4g。
[u]肝功能障礙患者的用藥[/u]:
參見【注意事項】部分。
[u]腎功能障礙患者的用藥[/u]:
腎功能明顯降低的患者(肌酐清除率[30ml/min)舒巴坦清除減少,應調整頭孢哌酮/舒巴坦的用藥方案。肌酐清除率為15-30ml/min的患者每日舒巴坦的最高劑量為2g,分等量,每12小時注射一次。肌酐清除率[15ml/min的患者每日舒巴坦的最高劑量為1g,分等量,每12小時注射一次。遇嚴重感染,必要時可單獨增加頭孢哌酮的用量。
在血液透析患者中,舒巴坦的藥物動力學特性有明顯改變。頭孢哌酮在血液透析患者中的血清半衰期輕微縮短。因此應在血液透析結束後給藥。
[u]靜脈給藥[/u]:
採用間歇靜脈滴注時,本品每瓶用適量的5%葡萄糖溶液或0.9%注射用氯化鈉溶液或滅菌注射用水溶解(參見【用法用量】[u]使用/操作說明[/u]本品的溶解部分),然後再用上述相同溶液稀釋至20mg,靜脈滴注時間應至少為15-60分鐘。
儘管乳酸鈉林格注射液可作為本品靜脈注射液的溶媒,但不能用於本品最初的溶解過程(參見【注意事項】[u]配伍禁忌[/u]乳酸鈉林格注射液部分和【用法用量】[u]使用/操作說明[/u]乳酸鈉林格注射液部分)。
採用靜脈推注時,本品應按上述方法溶解,靜脈推注時間至少應超過3分鐘。
[u]肌內注射[/u]:
儘管2%鹽酸利多卡因注射液可作為本品肌內注射液的溶媒,但不能用於本品最初的溶解過程(參見[u]配伍禁忌[/u]利多卡因部分和[u]使用/操作說明[/u]利多卡因部分)。
[u]使用/操作說明[/u]:
本品的溶解
本品每瓶內裝1.5g頭孢哌酮/舒巴坦。
總劑量(g) 相當於頭孢哌酮+舒巴坦的劑量(g) 稀釋液的體積(ml) 最高終濃度(mg/ml)
1.5 1.0+0.5 3.2 250+125
本品在頭孢哌酮和舒巴坦分別為10-250mg/ml和5-125mg/ml濃度範圍內,可與注射用水,5%葡萄糖注射液,生理鹽水,5%葡萄糖和0.225%氯化鈉注射液,5%葡萄糖和0.9%氯化鈉注射液等配伍。
乳酸鈉林格注射液
本品應使用滅菌注射用水進行溶解(參見【注意事項】[u]配伍禁忌[/u]乳酸鈉林格注射液部分)。採用兩步稀釋法:先用滅菌注射用水溶解(如上表所示),再用乳酸鈉林格注射液稀釋至舒巴坦的濃度為5mg/ml的溶液(用2ml初配液稀釋至50ml乳酸鈉林格注射液中或4ml初配液稀釋至100ml乳酸鈉林格注射液中)。
利多卡因
本品應使用滅菌注射用水溶解(參見【注意事項】[u]配伍禁忌[/u]利多卡因部分)。
為獲得濃度≥250mg/ml的頭孢哌酮溶液,應採用兩步稀釋法:先用滅菌注射用水溶解(如上表所示),再用2%利多卡因溶液稀釋,使約0.5%鹽酸利多卡因溶液中頭孢哌酮和舒巴坦的濃度分別達到250mg/ml和125mg/ml。
不良反應
通常不良事件是從臨床試驗期間及產品上市後的報告中收集的。很多事件可能是由用藥以外的因素如潛伏的疾病引起的。由於多數情況下不可能確定特定的因果關係(甚至許多不良事件並不是藥物不良反應),因此即便在不能確定是否由本品引起的情況下,也在此報告了所收集到的所有不良事件。本品通常耐受良好,大多數不良反應為輕度或中度,可以耐受,不影響繼續治療。從約有2500位患者參加的比較性或非比較性臨床試驗資料庫中觀察到下列不良反應:
[u]胃腸道反應[/u]:與其他抗生素一樣,本品最常見的副作用為胃腸道反應。有報導,腹瀉/稀便最為常見(3.9%),其次為噁心和嘔吐(0.6%)。
[u]皮膚反應[/u]:有報導,與所有青黴素類和頭孢菌素類抗生素一樣,過敏反應表現為斑丘疹(0.6%)和蕁麻疹(0.08%)。這些過敏反應易發生在有過敏史,特別是對青黴素過敏的患者中。
[u]血液系統[/u]:曾報導有患者出現中性粒細胞輕微減少(0.4%,5/1131)。與其他β-內醯胺類抗生素一樣,長期使用本品可發生可逆性中性粒細胞減少症(0.5%,9/1696)。在治療過程中,某些患者可出現直接庫姆斯試驗陽性反應(5.5%,15/269)。與文獻中有關其他頭孢菌素的報導一樣,本品可降低血紅蛋白(0.9%,13/1416)和血細胞比積(0.9%,13/1409)。曾發生過一過性嗜酸細胞增多(3.5%,40/1130)和血小板減少症(0.8%,11/1414)。有報導,發生過低凝血酶原血症(3.8%,10/262)。
[u]其他[/u]:頭痛(0.04%)、發熱(0.5%)、注射部位疼痛(0.08%)和寒戰(0.04%)。
[u]實驗室檢查異常[/u]:曾發現肝功能一過性升高,血清門冬氨酸轉氨酶(SGOT)為5.7%(94/1638),血清丙酮酸轉氨酶(SGPT)為6.2%(95/1529),鹼性磷酸酶為2.4%(37/1518),膽紅素為1.2%(12/1040)。
[u]局部反應[/u]:本品肌內注射耐受良好,偶有注射後注射部位出現一過性疼痛。與其他青黴素類和頭孢菌素類抗生素一樣,當通過靜脈插管注射本品時,某些患者可在注射部位發生靜脈炎(0.1%)。
有報導,本品上市後還發生了下列不良反應:一般不良反應:過敏反應(包括休克),心血管系統:低血壓,胃腸道:偽膜性腸炎,造血系統:淋巴細胞減少症,皮膚/附屬檔案:瘙癢,Stevens-Johnson綜合徵,泌尿系統:血尿,血管系統:血管炎。
禁忌
已知對青黴素類、舒巴坦、頭孢哌酮及其它頭孢菌素類抗生素過敏者禁用。
注意事項
1.[u]過敏反應[/u]
有報導,接受β-內醯胺類或頭孢菌素類抗生素治療的患者可發生嚴重的及偶可發生的致死性過敏反應。這些過敏反應更易發生在對多種過敏原有過敏史的患者中。一旦發生過敏反應,應立即停藥並給予適當的治療。
發生嚴重過敏反應的患者須立即給予腎上腺素緊急處理,必要時應吸氧、靜脈給予激素,並採用包括氣管內插管在內的暢通氣道等治療措施。
2.[u]肝功障礙患者的用藥[/u]
頭孢哌酮主要經膽汁排泄。當患者有肝臟疾病和/或膽道梗阻時,頭孢哌酮的血清半衰期通常延長並且由尿中排出的藥量會增加。即使患者有嚴重肝功能障礙時,頭孢哌酮在膽汁中仍能達到治療濃度並且其半衰期延長2-4倍。
遇到嚴重膽道梗阻、嚴重肝臟疾病或同時合併腎功能障礙時,可能需要調整用藥劑量。
同時合併有肝功能障礙和腎功能損害的患者,應監測頭孢哌酮的血清濃度,根據需要調整用藥劑量。對這些患者如未密切監測本品的血清濃度,頭孢哌酮的每日劑量不應超過2g。
3.[u]一般注意事項[/u]
與其他抗生素一樣,少數患者使用頭孢哌酮治療後出現了維生素K缺乏,其機制很可能與合成維生素的腸道菌群受到抑制有關,包括營養不良、吸收不良(如肺囊性纖維化患者)和長期靜脈輸注高營養製劑在內的患者存在上述危險。應監測上述這些患者以及接受抗凝血藥治療患者的凝血酶原時間,需要時應另外補充維生素K。
與其他抗生素一樣,長期使用本品可引起不敏感細菌過度生長。因此在治療過程中應仔細觀察患者的病情變化。與其他全身套用的抗生素一樣,建議在療程較長時應定期檢查患者是否存在各系統器官的功能障礙,其中包括腎臟、肝臟和血液系統。這一點對新生兒,尤其是早產兒和其他嬰兒特別重要。
4.幾乎所有抗菌藥物的套用都有難辨梭菌相關性腹瀉(CDAD)的報告,其中包括頭孢哌酮鈉/舒巴坦鈉,其嚴重程度可表現為輕度腹瀉至致命性腸炎。抗菌藥物治療可引起結腸正常菌群的改變,導致難辨梭菌的過度生長。
難辨梭菌產生的毒素A和毒素B與CDAD的發病有關。高產毒的難辨梭菌導致發病率和死亡率升高,這些感染可能對抗藥物治療無效,有可能需要結腸切除。對於所有使用抗生素後出現腹瀉的患者,必須考慮到CDAD的可能。由於曾經有給予抗菌藥物治療之後超過2個月發生CDAD的報導,因此需仔細詢問病史。
5.[u]對駕駛和操作機器能力的影響[/u]
頭孢哌酮/舒巴坦臨床套用經驗表明,本品不會降低患者駕駛和操作機器的能力。
6.[u]配伍禁忌[/u]
氨基糖苷類抗生素:由於本品與氨基糖苷類抗生素之間有物理性配伍禁忌,因此兩種藥液不能直接混合。如確需本品與氨基糖苷類抗生素合用時(參見【適應症】[u]聯合用藥[/u]部分),可採用序貫間歇靜脈輸注給藥,但必須使用不同的靜脈輸液管,或在輸液間歇期用一種適宜的稀釋液充分沖洗先前使用過的靜脈輸液管。另外,建議在全天用藥過程中本品與氨基糖苷類抗生素兩者給藥的間隔時間儘可能長一點。
乳酸鈉林格注射液:由於本品與乳酸鈉林格注射液混合後有配伍禁忌,因此應避免在最初溶解時使用該溶液。在兩步稀釋法中,先用注射用水進行最初的溶解,再用乳酸鈉林格注射液作進一步稀釋,從而得到能夠相互配伍的混合藥液(參見【用法用量】[u]使用/操作說明[/u]乳酸鈉林格注射液部分)。
利多卡因:由於本品與2%鹽酸利多卡因注射液混合後有配伍禁忌,因此應避免在最初溶解時使用此溶液。在兩步稀釋法中,先用注射用水進行最初的溶解,再用2%鹽酸利多卡因注射液作進一步稀釋,從而得到能夠相互配伍的混合藥液(參見【用法用量】[u]使用/操作說明[/u]利多卡因部分)。
孕婦及哺乳期婦女用藥
曾在大鼠中進行了生殖研究,所用劑量高達人體用量的10倍,未發現其生育能力受到損害,也未發現藥物有任何致畸作用。舒巴坦和頭孢哌酮均可通過胎盤屏障,但尚未在妊娠婦女中進行過足夠的和有良好對照的試驗。由於動物生殖研究的結果通常不能預測人體的情況,因此,只有在醫生認為必要時孕婦才能使用本品。
哺乳期用藥
只有少量的舒巴坦和頭孢哌酮能分泌到人體的母乳中。儘管只有少量的舒巴坦和頭孢哌酮能夠進入到母乳中,但哺乳期婦女仍應小心使用本品。
兒童用藥
 舒普深
舒普深本品兒童每日推薦劑量如下:
上述劑量分成等量,每6至12小時注射一次。
在嚴重感染或難治性感染時,上述劑量可按2:1的比例增加到每日240mg/kg(頭孢哌酮每日160mg/kg),分等量,每日給藥2-4次(參見【兒童用藥】[u]嬰兒用藥[/u]部分及【藥理毒理】臨床前安全性資料兒童用藥部分)。
[u]新生兒用藥[/u]
出生頭一周的新生兒應每12小時給藥一次。舒巴坦在患兒中的每日最高劑量不應超過80mg/kg,如需本品在患兒中的頭孢哌酮日劑量超過80mg/kg,則必須採用2:1的本品(參見【兒童用藥】[u]嬰兒用藥[/u]部分)。
[u]嬰兒用藥[/u]
本品已被有效地用於嬰兒感染的治療。對早產兒和新生兒尚未進行過廣泛的研究,因此本品用於早產兒和新生兒前,醫生應充分權衡利弊(參見【藥理毒理】[u]臨床前安全性資料[/u]兒童用藥部分)。
頭孢哌酮不能將膽紅素從血漿蛋白結合部位中置換出來。
老年用藥
參見【藥代動力學】老年患者用藥部分。
藥物相互作用
有報導,患者在使用頭孢哌酮期間及停藥後5天內飲酒可引起面部潮紅、出汗、頭痛和心動過速等特徵性反應,其他一些頭孢菌素也曾報導有類似反應。因此患者使用頭孢哌酮/舒巴坦時,如同時飲用含有酒精的飲料應格外注意。當患者需要腸內或腸外營養時,應避免給予含有酒精成份的液體。
[u]實驗室檢查中的藥物相互作用[/u]
使用Bennedict溶液或Fehling試劑檢查尿糖時,可出現假陽性反應。
藥物過量
有關人體發生頭孢哌酮鈉和舒巴坦鈉急性中毒的資料很少。預期本品藥物過量所出現的臨床表現主要是那些已被報導的不良反應的擴大。腦脊液中高濃度的β-內醯胺類抗生素可引起中樞神經系統不良反應,如抽搐等。由於頭孢哌酮和舒巴坦均可通過血液透析從血循環中被清除,因此如腎功能損害的患者發生藥物過量,血液透析治療可增加本品從體內的排出。
藥理毒理
 舒普深
舒普深 舒普深
舒普深頭孢哌酮/舒巴坦的抗菌成分為頭孢哌酮,為第三代頭孢菌素,通過在細菌繁殖期抑制敏感細菌細胞壁粘肽的生物合成而達到殺菌作用。舒巴坦除對奈瑟菌科和不動桿菌外,對其它細菌不具有任何有效的抗菌活性。但用細菌進行的生化研究顯示,舒巴坦對由β-內醯胺類抗生素耐藥菌株產生的多數重要的β-內醯胺酶具有不可逆性的抑制作用。
通過對耐藥菌全細胞的研究證實,舒巴坦可防止耐藥菌對青黴素類和頭孢菌素類抗生素的破壞,並且舒巴坦與青黴類和頭孢菌素類抗生素具有明顯的協同作用。由於舒巴坦可與某些青黴素結合蛋白相結合,因此敏感菌株通常對頭孢哌酮/舒巴坦的敏感性較單用頭孢哌酮時更強。
頭孢哌酮/舒巴坦複方製劑對所有對頭孢哌酮敏感的細菌均具有抗菌活性。另外它對多種細菌,特別是下列細菌表現出協同抗菌作用(頭孢哌酮/舒巴坦複方製劑較其中單種成分的最低抑菌濃度(MIC)值至少降低4倍)。
流感嗜血桿菌、擬桿菌屬、葡萄球菌屬、醋酸鈣不動桿菌、產氣腸桿菌、大腸桿菌、奇異變形桿菌、肺炎克雷白菌、摩根摩根氏菌、弗勞地枸櫞酸菌、陰溝腸桿菌、異形枸櫞酸桿菌
在體外試驗中,頭孢哌酮/舒巴坦對臨床許多重要致病菌具有抗菌活性:
革蘭陽性菌:金黃色葡萄球菌,產生和不產生青黴素酶的菌珠、表皮葡萄球菌屬、肺炎璉球菌(以往稱肺炎雙球菌)、化膿性鏈球菌(A組β—溶血性鏈球菌)、無乳鏈球菌(B組β—溶血性鏈球菌)、β—溶血性鏈球菌的多數菌株、糞腸球菌的許多菌珠
革蘭陰性菌:大腸桿菌、克雷白菌屬、腸桿菌屬、枸櫞酸菌屬、流感嗜血桿菌、奇異變形桿菌、普通變形桿菌、摩根摩根氏菌(以往稱摩根變形桿菌)、雷極普羅菲登氏菌(以往稱雷極變形桿菌)、普羅菲登氏菌屬、沙雷菌屬(包括粘質沙雷菌)、沙門菌屬和志賀菌屬、銅綠假單胞菌和某些其它假單胞菌屬、醋酸鈣不動桿菌、淋球菌、腦膜炎球菌、百日咳桿菌、小腸結腸炎耶爾森菌
厭氧菌:革蘭陰性桿菌(包括脆弱擬桿菌、其他擬桿菌屬和棱桿菌屬)、革蘭陽性和革蘭陰性球菌(包括消化球菌、消化鏈球菌和韋榮氏球菌屬)、革蘭陽性桿菌(包括梭狀芽孢桿菌、真桿菌和乳桿菌屬)
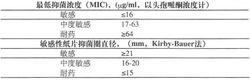
下列所示為已建立的頭孢哌酮/舒巴坦的敏感性範圍:
採用肉湯稀釋法或瓊脂稀釋法對1:1或2:1的頭孢哌酮/舒巴坦進行逐步稀釋以獲得其最低抑菌濃度(MIC)。推薦採用含75μg頭孢哌酮和30μg舒巴坦的藥敏紙片。如敏感性試驗報告“敏感”,表明頭孢哌酮/舒巴坦治療感染的病原菌可能有效;如報告“耐藥”,表明頭孢哌酮/舒巴坦治療感染的病原菌可能無效;如報告“中度敏感”,表明如給予較高劑量或感染局限在有高濃度本品的組織或體液時,病原菌可能對頭孢哌酮/舒巴坦敏感。
[u]臨床前安全性資料[/u]
頭孢哌酮在所有測試劑量下對青春期前大鼠的睪丸均產生不良反應。每日皮下注射1000mg/kg(約為成人平均劑量的16倍)可導致大鼠睪丸重量降低,精子生成受到抑制,生殖細胞數量減少和足細胞胞漿內空泡形成。損害的嚴重程度在每日100-1000mg/kg範圍內與所用劑量的高低有關,低劑量可引起精子細胞輕微減少,在成年大鼠中未觀察到這種作用。除最高劑量外,這種組織學損害在各劑量組中均為可逆性的。儘管如此,這些試驗並未對大鼠以後的生殖功能進行評價。尚未確定上述發現與人體的關係。
在新生大鼠每日300mg+300mg/kg用藥組中發現,頭孢哌酮/舒巴坦(1:1)皮下注射1個月後可導致大鼠睪丸重量降低,關且出現未成熟的小管。由於年幼大鼠睪丸的成熟情況存在很大程度的個體差異,並且在對照組中也能發現未成熟的睪丸,因此尚不確定上述現象是否與試驗藥物有關。給予嬰幼犬超過成人平均劑量10倍的頭孢哌酮/舒巴坦時並未發現上述情況。
藥代動力學
注射頭孢哌酮/舒巴坦後,其中約84%的舒巴坦和25%的頭孢哌酮經腎臟排泄,其餘的頭孢哌酮大部分經膽汁排泄。注射頭孢哌酮/舒巴坦後,舒巴坦的平均半衰期約為1小時,頭孢哌酮為1.7小時。血藥濃度與給藥劑量成正比。數值與已發表的兩者單獨使用的數值一致。
靜脈注射2g頭孢哌酮/舒巴坦(1g頭孢哌酮和1g舒巴坦)5分鐘後,頭孢哌酮和舒巴坦的平均血峰濃度分別為236.8μg/ml和130.2μg/ml,提示舒巴坦分布容積(Vd=18.0-27.6升)大於頭孢哌酮的分布容積(Vd=10.2-11.3升)。
肌內注射1.5g頭孢哌酮/舒巴坦(1g頭孢哌酮和0.5g舒巴坦)後,舒巴坦和頭孢哌酮在15分鐘至2小時血清濃度達到峰值,頭孢哌酮和舒巴坦的平均血清峰濃度分別為64.2μg/ml和19.0μg/ml。
頭孢哌酮和舒巴坦均能較好地分布到各組織和體液,包括膽汁、膽囊、皮膚、闌尾、輸卵管、卵巢、子宮和其他組織及體液中。
無證據表明注射頭孢哌酮/舒巴坦複方製劑後兩種組分之間存在藥物動力學相互作用。
有報導,頭孢哌酮/舒巴坦多劑給藥後兩種組分的藥物動力學參數均無顯著變化,每8-12小時注射一次時未發現藥物蓄積。
[u]肝功能不全患者用藥[/u]:參見【注意事項】部分。
[u]腎功能不全患者用藥[/u]:不同程度腎功能障礙患者注射頭孢哌酮/舒巴坦後,舒巴坦的藥物總清除率與估計的肌酐清除率密切相關。在腎功能衰竭患者中,舒巴坦的半衰期明顯延長(在兩項研究中分別平均為6.9小時和9.7小時)。在血液透析患者中,舒巴坦的半衰期、藥物總清除率和表觀分布容積均發生了明顯改變,未觀察到頭孢哌酮的藥物動力學參數在腎功能衰竭患者中有顯著差異。
[u]老年患者用藥[/u]:在伴有腎功能不全和肝功能受損的老年人群中進行了頭孢哌酮/舒巴坦的藥物動力學參數的研究,與正常健康受試者相比,在這些患者中舒巴坦和頭孢哌酮均顯示出半衰期延長,藥物清除減少和表觀分布容積增加。舒巴坦的藥物動力學參數與腎功能的損害程度高度相關,而頭孢哌酮的藥物動力學參數則與肝功能的損害程度關係密切。
[u]兒童用藥[/u]:在兒科患者中進行的研究顯示,與成人數據相比頭孢哌酮/舒巴坦各成份的藥物動力學參數無明顯改變。舒巴坦在兒童中的半衰期範圍為0.91至1.42小時,頭孢哌酮為1.44至1.88小時。
貯藏
密閉保存。
包裝
模製抗生素瓶,1瓶/盒。
有效期
24個月。
執行標準
《中國藥典》2010年版二部。
貯藏條件按照國家藥品標準頒布件(1999)國藥標字X-042-10-2011號的補充頒布件(批件號2011B024)執行。
批准文號
1.5g 國藥準字H20020597
3.0g 國藥準字H20020598
生產企業
輝瑞製藥有限公司
核准日期
2007年03月09日
修訂日期
2009年05月22日 2010年10月01日 2010年10月19日 2011年09月08日

