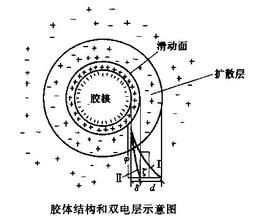
簡介
膠體因質點很小,強烈的布朗運動使它不致很快沉降,故具有一定的動力學穩定性;另一方面,疏液膠體是高度分散的多相體系,相界面很大,質點之間有強烈的聚結傾向,所以又是熱力學不穩定體系。一旦質點聚結變大,動力學穩定性也隨之消失。因此,膠體的聚結穩定性是膠體穩定與否的關鍵。疏液膠體,尤其是水溶膠,常因質點帶電而穩定。但它對電解質十分敏感,在電解質作用下膠體質點聚結而下沉的現象稱為聚沉,聚沉是膠體不穩定的主要表現。在指定條件下使溶膠聚沉所需電解質的最低濃度稱為聚沉值,用毫摩爾/升表示。因為判斷聚沉的標準與實驗條件有關,故聚沉值是一個與實驗條件有關的相對數值。
影響因素
反離子的價數
起聚沉作用的主要是電荷與膠體相反的離子(稱為反離子)。反離子的價數越高,則聚沉效率越高,聚沉值越低。一價反離子的聚沉值約為 25~150,二價的為0.5~2,三價的為0.01~0.1。聚沉值大致與反離子價數的六次方成反比,這稱為舒爾茨-哈代規則。離子大小
同價數的反離子的聚沉值雖然相近,但仍有差別,一價離子聚沉值的差別尤其明顯,同價離子聚沉能力的這一次序稱為感膠離子序,它和水化離子半徑由小至大的次序大致相同,故聚沉能力的差別主要受離子大小的影響。但此規律只適用於小的不相干離子,有機大離子因其與質點之間有較強的范德瓦耳斯力而易被吸附,聚沉值要小得多。同號離子 一般來說,二價或高價負離子對於帶負電的膠體有一定的穩定作用,使正離子的聚沉值略有增加;高價正離子對於帶正電的膠體也有同樣作用。同號大離子對膠體的穩定作用更為明顯。
不規則聚沉
少量的電解質可使溶膠聚沉,電解質濃度高時,沉澱重又分散;濃度再高時又使溶膠聚沉。這種現象以用高價離子或大離子為聚沉劑時最為顯著,叫做不規則聚沉。對於靠靜電穩定的疏液膠體,存在一個臨界電勢ζ0,若質點的電動電勢|ζ|<ζ0,則發生聚沉。多數膠體的ζ0在30毫伏左右。只要|ζ|>ζ0,不管其符號如何,皆可達到穩定。高價或大的反離子先是使膠體的 ζ電勢降低,發生聚沉;而後由於它在質點表面上的強烈吸附,質點的 ζ電勢反號,絕對值增加,溶膠重又穩定;再加入電解質,由於反離子的作用又使溶膠聚沉,這就是發生不規則聚沉的原因。高分子的影響
在疏液膠體中加入高分子,往往顯著提高膠體的穩定性,稱為高分子的保護作用。因其與高分子在質點表面上形成阻止質點聚結的吸附層有關,又稱為空間穩定作用。工業上常利用高分子的保護作用製備穩定的分散體,尤其是濃分散系或非水分散系,例如油漆。高分子須超過一定濃度才起穩定作用,低於此濃度時,膠體的穩定性往往變差,對電解質更加敏感,此即高分子的敏化作用。某些高分子甚至能直接使膠體聚沉,這稱為絮凝作用。作絮凝劑使用的高分子可以是電性與膠體相反的高分子,也可以是不帶電,甚至電性與膠體相同的高分子電解質。高分子絮凝劑的用量少、效率高,在合適的條件下還可以進行選擇性絮凝,所以廣泛用於淨水、污水處理、礦泥回收等操作中。最常用的絮凝劑是部分水解的聚丙烯醯胺。理論
疏液膠體的穩定性理論通稱DLVO理論。此理論的出發點是:膠體質點間因范德瓦耳斯力而相互吸引,質點在相互接近時又因雙電層的重疊而產生排斥作用,膠體的穩定程度取決於上述兩種作用的相對大小。DLVO理論計算了各種形狀質點之間的范德瓦耳斯吸引能與雙電層排斥能隨質點間距離的變化。在質點相互接近的過程中,如果在某一距離上質點間的排斥能大於吸引能,膠體將具有一定的穩定性;若在所有距離上吸引皆大於排斥,則質點間的接近必導致聚結,膠體發生聚沉。溶液中的離子濃度或反離子的價數增加時,質點間的范德瓦耳斯力幾乎不受影響,但雙電層的排斥能卻因雙電層的壓縮而大大降低,因此膠體的穩定性下降,直至發生聚沉。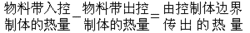 電勢ψ0的函式
電勢ψ0的函式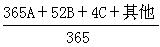
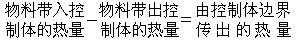
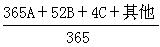 自DLVO理論得出
自DLVO理論得出關於空間穩定效應,至今尚未形成統一的定量理論。E.L.馬克在20世紀50年代初提出,高分子對疏液膠體的穩定作用主要是因為熵效應:質點的接近造成的空間限制使吸附在質點表面上的高分子的構型熵減小,從而使質點間相互作用自由能增加,產生排斥作用。後來的理論發展主要是對高分子構型熵計算方法的改進。另一方面,E.W.費歇爾等提出,質點相互接近時造成高分子吸附層的重疊,這可以看作是兩個一定濃度的高分子溶液的混合過程,涉及高分子鏈段之間和高分子與溶劑之間相互作用的變化。從高分子溶液理論和統計熱力學出發,可以分別計算混合過程的熵變與焓變,從而知道吸附層交聯時吉布斯函式變化的符號與大小。若吉布斯函式變化為正,則質點互相排斥,高分子吸附層起穩定作用;若吉布斯函式變化為負,則吸附的高分子起絮凝作用。上述兩種理論分別適用於高分子吸附層完全不能互相穿透與吸附層可以自由穿透這兩種極端情形。實際上當質點因布朗運動而互相碰撞時,吸附層的壓縮與穿透多半會同時發生。雖有人試圖將兩種理論統一起來,但尚未得到滿意的結果。
至於高分子絮凝劑的作用機理,除了電性相反的高分子電解質的靜電作用之外,更主要的是高分子的“搭橋”作用。若一個高分子長鏈能同時吸附在兩個或更多的質點上,則可能將質點拉在一起而聚沉。這通常發生在高分子濃度很稀時。倘若高分子濃度較高,則傾向於吸附在一個質點上形成保護層,起穩定作用。
Zeta電位
Zeta電位[mV]:0到±5,膠體穩定性:快速凝結或凝聚
Zeta電位[mV]:±10到±30,膠體穩定性:開始變得不穩定
Zeta電位[mV]:±30到±40,膠體穩定性:穩定性一般
Zeta電位[mV]:±40到±60,膠體穩定性:較好的穩定性
Zeta電位[mV]:超過±61,膠體穩定性:穩定性極好
麥克默瑞提克(上海)儀器有限公司Zeta電位與納米粒度儀NANOPLUS可同時滿足低濃度和高濃度樣品分析的要求,濃度範圍由0.001%到40%,可檢測粒徑從0.1nm到12.30μm,濃度從0.00001%到40%的樣品的粒徑。
Zeta電位的重要意義在於它的數值與膠態分散的穩定性相關。Zeta電位是對顆粒之間相互排斥或吸引力的強度的度量。
分子或分散粒子越小,Zeta電位(正或負)越高,體系越穩定,即溶解或分散可以抵抗聚集。反之,Zeta電位(正或負)越低,越傾向於凝結或凝聚,即吸引力超過了排斥力,分散被破壞而發生凝結或凝聚。