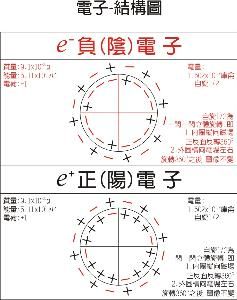
詳解
 雙電層
雙電層在兩種不同物質的界面上,正負電荷分別排列成的面層。在溶液中,固體表面常因表面基團的解離或自溶液中選擇性地吸附某種離子而帶電。由於電中性的要求,帶電錶面附近的液體中必有與固體表面電荷數量相等但符號相反的多餘的反離子。帶電錶面和反離子構成雙電層。
熱運動使液相中的離子趨於均勻分布,帶電錶面則排斥同號離子並將反離子吸引至表面附近,溶液中離子的分布情況由上述兩種相對抗的作用的相對大小決定。根據O.斯特恩的觀點,一部分反離子由於電性吸引或非電性的特性吸引作用(例如范德瓦耳斯力)而和表面緊密結合,構成吸附層(或稱斯特恩層)。其餘的離子則擴散地分布在溶液中,構成雙電層的擴散層(或稱古伊層)。由於帶電錶面的吸引作用,在擴散層中反離子的濃度遠大於同號離子。離表面越遠,過剩的反離子越少,直至在溶液內部反離子的濃度與同號離子相等。
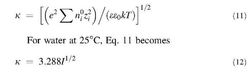 雙電層
雙電層由於電荷分離而造成的固液兩相內部的電位差,稱為表面電勢,通常用Ψ0表示。若溶液中某離子的濃度直接影響固體的表面電勢Ψ0,則該離子稱為決定電勢離子,例如AgI溶膠中的Ag+離子與I-離子。溶液中的其他離子則稱為不相干離子。斯特恩層中吸附離子的電性中心構成斯特恩平面,它與溶液內部之間的電勢差稱為斯特恩電勢,一般用Ψd表示。在斯特恩層中電勢自Ψ0近似直線地變化至 Ψd。除了吸附的反離子之外,還有一部分溶劑(水)偶極子也與帶電錶面緊密結合,作為整體一起運動。因此在電動現象中固液兩相發生相對運動時的滑動面是在斯特恩平面之外的溶液內某處。此滑動面與溶液內部的電位差稱為電動電勢或 ζ電勢。雙電層中的電勢變化如圖所示。按以上模型,ζ電勢應比Ψd略低,但只要溶液中電解質濃度不是很高,可以認為二者近似相等。在擴散層中,電勢隨離表面距離的變化大致呈指數關係。對於平的帶電錶面,若Ψ0不很高,則擴散層中的電勢隨離表面的距離x的變化可用下式表示:
式中κ的倒數稱為雙電層厚度,與溶液內部各種離子濃度(單位體積中的離子數目)及價數Zi有以下關係:
式中 e為電子電荷;ε為溶液的電容率;k為玻耳茲曼常數;T
 雙電層
雙電層擴散雙電層理論
溶膠粒子帶電,這些電荷的主要來源是從水溶液中選擇性地吸附某種離子:吸附正離子膠粒帶正電,吸附負離子帶負電,但整個溶液是電中性的,故還應有等量的反離子存在。固粒表面吸附的離子和溶液中的反離子構成雙電層。
反離子在溶液中受到兩個方向相反的作用:
1.固粒表面被吸附的離子的引力,力圖將它們拉向界面;
 雙電層
雙電層2.離子本身的熱運動,使之離開界面而擴散到溶液中去,
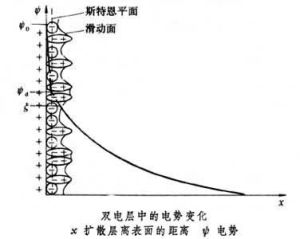
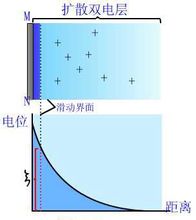
其結果使反離子在固粒表面外呈平衡分布:靠近界面處反離子濃度大些;隨著與界面距離的增大,反離子由多到少,形成擴散分布,如圖3-7所示。MN代表粒子的平表面,設它吸附負離子,則電量相等的正離子擴散分布,就好象大氣層中氣體分子按高度分布的狀態。直到界面負電荷電力所不及處,過剩離子濃度等於零。帶電錶面及這些反離子,就構成擴散雙電層。雙電層的厚度隨溶液中離子濃度和電荷數而不同。
實驗證明,溶膠粒子在電場下與溶液發生相對移動時,分界面不是在固液界面MN處,而是有一層液體牢固地附在固體表面,並隨表面運動。按電泳算出的就是此滑動面上的電勢,稱電動電勢或€-電勢。
€-電勢除受決定電勢的離子濃度影響外,還與溶液中其它電解質的濃度有關。當電解質濃度增加時,擴散層被壓縮、變薄;同時某些具有特異性吸附能力的離子加入後,還可使€-電勢符號改變。