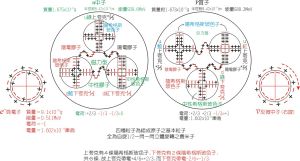
名詞解釋
電離能
意義電離能可以衡量元素的原子失去一個電子的難易程度(可近似理解為金屬性)。第一電離能第一電離能(原子失去最外層的一個電子所需能量)數值越小,原子越容易失去一個電子;第一電離能數值越大,原子越難失去一個電子。表達式
第一電離能的符號為I1,單位是kJ/mol。氣態原子形成+1價氣態陽離子的過程可表示為:M(g) — e- → M+ (g)(任何形態都一樣)規律
1.隨著核電荷數的遞增,元素的第一電離能呈現周期性變化。
2.總體上金屬元素第一電離能較小,非金屬元素第一電離能較大。3.同周期元素第一電離能從左到右有增大的趨勢。所以同一周期第一電離能最小的是鹼金屬元素,最大的是稀有氣體元素。4.同一周期內元素的第一電離能在總體增大的趨勢中有些曲折。當外圍電子在能量相等的軌道上形成全空(p0, d0, f0)、半滿(p3, d5, f7)或全滿(p6, d10, f14)結構時,原子的能量較低,元素的第一電離能較大。特例是第二主族的第一電離能大於第三主族,第五主族的第一電離能大於第六主族。5.同一主族元素從上到下,原子半徑增加,有效核電荷增加不多,則原子半徑增大的影響起主要作用,第一電離能由大變小,元素的金屬性逐漸增強。6.同一副族第一電離能變化不規則