簡介
熱化學(Thermochemistry)的測量曾對物理化學的發展起過重要作用。在現代,由於科學技術的進步,量熱方法得到了改進,特別是熱測量精度的提高,熱化學在燃料、食品以及生物和藥物等領域仍具重要意義。熱化學的數據(如燃燒熱、生成熱等)在熱力學計算、工程設計和科學研究等方面都具有廣泛的套用。熱化學,研究物理和化學過程中熱效應規律的學科。是化學的一支,也是物理學中熱學在化學中的套用。
定律
 熱化學脫水器
熱化學脫水器是自然界的一條普遍規律,它是人們在生產實踐和科學實驗的基礎上總結出來的,它又叫做 ,恩格斯將它譽為19世紀自然科學中具有決定意義的三大發現之一。這個定律的主要內容是:能量有各種不同的形式,能從一種形式轉化為另一種形式,從一個物體傳遞給另一個物體,而在轉化和傳遞中,能量的數值保持不變。把熱力學第一定律具體運用到化學反應上,用實驗測定和計算化學反應的熱量,研究這方面問題的科學稱為熱化學。
化學反應熱效應
定義 :當生成物與反應物溫度相同時,化學反應過程中的吸收或放出的熱量。化學反應熱效應一般稱為反應熱。
注意必須具備以下條件才是化學反應熱效應:
(a)生成物的溫度和反應物的溫度相同,避免將使生成物溫度升高的或降低所引起的熱量變化混入到反應熱中。
(b)只做體積功不做其它功。
恆容反應熱QV
容量恆定過程中完成的反應稱恆容反應,其熱效應稱恆容反應熱QV
QV=∆U即恆容反應過程中,體系吸收的熱量全部用來改變體系的內能。
恆壓反應熱QP
壓強恆定過程中完成的化學反應稱為恆壓反應,其熱效應稱為恆壓反應熱QP
定義狀態函式 H=U+PV · · · · · ·焓
焓變:∆H = H2-H1
QP =∆H即在恆壓反應過程中,體系吸收的熱量全部用來改變體系的熱焓,其成立必須具備三個條件
研究方向
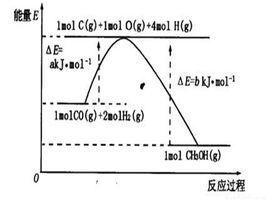
 熱化學反應式
熱化學反應式熱化學主要是研究化學反應中的熱量轉化問題的。化學反應除了以熱的形式與外界環境進行能量交換外,往往還以功的形式進行交換。例如,火藥爆炸產生膨脹功,化學電池在電動勢作用下輸送電荷而作電功等。本節提到的“在化學反應中,在物質變化的同時,還伴隨有能量的變化,這種能量變化,常以熱能的形式表現出來”。這裡的“常以”是指除了以熱的形式外,還以功的形式進行能量交換。應當指出,熱化學裡所討論的化學反應,都是在一定條件下只作膨脹功,而不作非膨脹功(如電功)的反應。
同一反應,在不同條件下熱量的變化不同。如果不指明反應條件而談熱量的多少,是沒有意義的。同時,要想比較不同的化學反應的反應熱,必須規定反應在同樣的條件下進行。為此,規定在壓強為101 kPa和25 ℃的條件下的反應熱為標準反應熱,以便於比較。按狀態變化過程的不同,反應熱可分為等壓反應熱、等容反應熱;按化學變化的類別不同,反應熱可分為生成熱、燃燒熱、中和熱等等。
氣相沉積
 熱化學
熱化學熱化學氣相沉積是指採用襯底表面熱催化方式進行的化學氣相沉積。該方法沉積溫度較高,一般在800℃~1200℃左右,這樣的高溫使襯底的選擇受到很大限制,但它是化學氣相沉積的經典方法。
溫度
 第一定律和熱化學
第一定律和熱化學熱力學溫度,又叫熱力學標溫,符號T,單位K(開爾文,簡稱開)。早在1787年法國物理學家查理(J.Charles)就發現,在壓力一定時,溫度每升高1℃,一定量氣體的體積的增加值(膨脹率)是一個定值,體積膨脹率與溫度呈線性關係。起初的 得出該定值為氣體在0℃時的體積的1/269,後來經許多人歷經幾十年的實驗修正,其中特別是1802年法國人蓋·呂薩克(J.L.Gay-Lussac)的工作,最後確定該值1/273.15。將上述氣體體積與溫度的關係用公式來表示,形式如下:
V=V0(1+t/273.16)=V0(t+273.15)/273.15
 熱化學定律
熱化學定律式中V是攝氏溫度為t/℃時的氣體體積。若定義t+273.15≡T(於是0+273.15=T0,單位:K),上述關係就可以用形式更簡單的公式來表達:V/T=V0/T0,進一步看,V1/T1=V0/T0,V2/T2=V0/T0,……,自然有V1/T1=V2/T2,即在任何溫度下一定量的氣體,在壓力一定時,氣體的體積V與用T為溫標表示的溫度成反比。這叫做查理-蓋·呂薩克定律。事實上這種關係只適用於理想氣體。為此,人們起先把T稱為理想氣體溫度(溫標),又叫絕對溫度(溫標)。在熱力學形成後,發現該溫標有更深刻的物理意義,特別是克勞修斯(Claosius)和開爾文(Kelvin)論證了絕對零度不可達到,便改稱熱力學溫度(溫標),並用Kelvin第一個字母K為其單位。物體的溫度是構成物體的大量微粒運動(熱運動)的激烈程度的巨觀體現。例如由單原子分子構成的氣體的大量分子的平均動能Ek與它的溫度T的關係經統計熱力學理論推導為:
E(—)k=3/2kT
其中k=1.381×10-23J/K,被稱為玻爾茲曼(Boltzmann)常量,等於氣體常量R與阿伏加德羅常量N0之比。
作家
瑞典化學家索雷特