學科分類
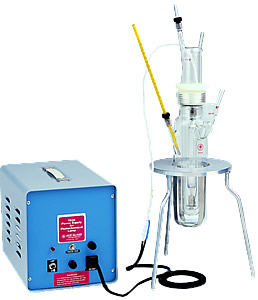 美國ace glass 光化學反應系統
美國ace glass 光化學反應系統光化學過程可分為初級過程和次級過程。初級過程是分子吸收光子使電子激發,分子由基態提升到激發態,激發態分子的壽命一般較短。光化學主要與低激發態有關,激發態分子可能發生解離或與相鄰的分子反應,也可能過渡到一個新的激發態上去,這些都屬於初級過程,其後發生的任何過程均稱為次級過程。例如氧分子光解生成兩個氧原子,是其初級過程;氧原子和氧分子結合為臭氧的反應則是次級過程,這就是高空大氣層形成臭氧層的光化學過程。分子處於激發態時,由於電子激發可引起分子中價鍵結合方式的改變,使得激發態分子的幾何構型、酸度、顏色、反應活性或反應機理可能和基態時有很大的差別,因此光化學反應比熱化學反應更加豐富多采。
光化學反應已經廣泛用於合成化學,由於吸收給定波長的光子往往是分子中某個基團的性質,所以光化學提供了使分子中某特定位置發生反應的最佳手段,對於那些熱化學反應缺乏選擇性或反應物可能被破壞的體系,光化學反應更為可貴。大氣污染過程也包含著極其豐富而複雜的光化學過程,例如氟里昂等氟碳化物在高空大氣中光解產物可能破壞臭氧層,產生臭氧層“空洞”。
 光子-模型圖
光子-模型圖  電子-模型圖
電子-模型圖 學科內容
 半導體光化學
半導體光化學電磁輻射能的吸收與分子的激發態
光化學的初級過程是分子吸收光子使電子激發,分子由基態提升到激發態。分子中的電子狀態、振動與轉動狀態都是量子化的,即相鄰狀態間的能量變化是不連續的。因此分子激發時的初始狀態與終止狀態不同時,所要求的光子能量也是不同的,而且要求二者的能量值儘可能匹配。由於光子的能量ε=hv=hc/λ(式中h為普朗克常數;v為光的頻率;λ為光的波長;c為光速),所以能量匹配體現為光的波長的匹配。
分子在一般條件下處於能量較低的穩定狀態,稱作基態。受到光照射後,如果分子能夠吸收分子,就可以提升到能量較高的狀態,稱作激發態。如果分子可以吸收不同波長的電磁輻射,就可以達到不同的激發態。按其能量的高低,從基態往上依次稱做第一激發態、第二激發態等等;而把高於第一激發態的所有激發態統稱為高激發態。激發態分子的壽命一般較短,而且激發態越高,其壽命越短,以致於來不及發生化學反應,所以光化學主要與低激發態有關。激發時分子所吸收的電磁輻射能有兩條主要的耗散途徑:一是和光化學反應的熱效應合併;二是通過光物理過程轉變成其他形式的能量。光物理過程又可分為:①輻射弛豫過程,即將全部或一部分多餘的能量以輻射能的形式耗散掉,分子回到基態,如發射螢光或磷光;②非輻射弛豫過程,多餘的能量全部以熱的形式耗散掉,分子回到基態(見雅布隆斯基態圖解)。
如果分子中的電子是一一配對的(電子自鏇方向相反),這種狀態在光譜學上稱為單重(線)態(在分子式左上角用上標1表示,如A,或記作S,依能量由低至高分別用S0、S1、…表示)。若分子中有兩個電子的自鏇平行,這種狀態稱為三重(線)態(用A或T1、T2、…表示)。單重態的激發態壽命很短,一般在10~10秒的量級。當基態為單重態時,激發三重態的壽命一般較長,可達到10~10秒的量級。所以有機化合物的光化學大都是三重態的光化學。
分子處於激發態時,由於電子激發可引起分子中價鍵結合方式的改變〔如電子由成鍵的 π軌道躍遷到反鍵的π軌道,記作(π,π);或由非鍵的n軌道躍遷到反鍵的π軌道,記作(n,π)等〕,使得激發態分子的幾何構型、酸度、顏色、反應活性或反應機理可能和基態時有很大的差別,因此光化學比基態(熱)化學更加豐富多采。
量子產率
也叫量子效率或量子產額。是光化學重要的基本量之一。設反應為A hv→B,初級過程的量子產率定義為:
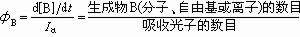
如果激發態的A分子在變成為B的同時,還平行地發生著其他光化學和光物理過程,那么這個初級過程的量子產率將受到其他競爭的平行過程的“量子產率”的影響。由於在一般光強條件下,每個分子只能吸收1個光子,所以所有初級過程的量子產率的總和應等於1。
量子效率的測定有絕對測定法與相對測定法。相對法指與一種其絕對量產率為已知的體系相比較的方法。絕對法則要求直接建立起反應的量子產率和波長、溫度、光強以及各種離子(特別是氫離子)濃度間的函式關係。現在已經研究過的這類體系有氣體體系(如一氧化二氮、二氧化碳、溴化氫、丙酮等);液相體系(如草酸鐵(Ⅲ)鉀溶液、草酸鈾醯溶液、二苯酮-二苯甲醇、2-己酮、偶氮苯、苯甲酸等〕;固相體系(如硝基苯甲醛、二苯酮-二苯甲醇等)。這些方法所用的儀器統稱為化學露光計。
次級步驟
如果一個激發態分子不是直接回到它的最低能態,它必須發生以下過程:解離(產生自由電子、原子、自由基或分子碎片);與相鄰的同種或不同種分子反應;過渡到一個新的激發態上去。這些過程可以平行地發生,也可以只發生其中的一種或幾種,但這些都屬於光化學的初級過程。其後的任何步驟均稱為次級步驟。例如氧分子光解後生成兩個氧原子,是其初級過程;在純氧中將發生的重要次級過程是氧原子和氧分子結合為臭氧的反應;氧和臭氧在典型的城市大氣中又都可以和碳氫化合物進行一系列反應,所有這些反應都可以稱為次級步驟。
原子從分子中的一處移向他處的反應稱為分子重排反應。許多有機分子在光激發後發生的重排過程也屬於次級步驟。如苯經光激發後變為亞甲基環戊二烯的反應:
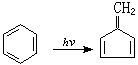
第一步只是苯環中6個比較自由的共軛 π電子的激發(一般只激發1個電子),這對苯分子中的碳氫鍵影響不大;而在次級步驟中由於原子的重排,生成了結構完全不同的產物。
有時,初級光化學過程可用作研究次級反應的工具,光敏化反應就屬於這類情況。如汞原子能有效地吸收汞燈發射的光而被激發,然後通過與其他分子的碰撞,傳遞所吸收的能量。例如:
Hg+hv─→Hg
Hg+N2O─→Hg+N2+O
氧原子可以和體系中存在的其他物質反應,從釋放出來的氮氣量可以計算出所產生的氧原子數量。
如果初級光化學步驟是分子光解成兩個自由基(有單個或未配對電子的分子碎片),通常,其次級步驟為鏈反應。氫與氯的反應是已經熟知的例子,其過程為:
hv+Cl2─→2Cl
Cl+H2─→HCl+H
H+Cl2─→HCl+Cl
在鏈反應中,每個量子可以產生多個產物分子,因此這類反應的總量子產率不僅可能大於1,有時可以達到幾百甚至幾千。所以當量子產率大於1時,一般可考慮反應具有鏈反應的機理。
決定一個光化學反應的真正途逕往往需要建立若干個對應於不同機理的假想模型,找出各模型體系與濃度、光強及其他有關參量間的動力學方程,然後考察何者與實驗結果的相符合程度最高,以決定哪一個是最可能的反應途徑。研究反應機理的常用實驗方法,除示蹤原子標記法外,在光化學中最早採用的猝滅法仍是非常有效的一種方法。這種方法是通過被激發分子所發螢光被其他分子猝滅的動力學測定來研究光化學反應機理的。它可以用來測定分子處於電子激發態時的酸性、分子雙聚化的反應速率和能量的長程傳遞速率。猝滅是一種雙分子過程,如原激發分子為A,猝滅劑分子為Q,此過程為:
A+Q─→A+Q
顯然猝滅過程也是一種敏化過程。Q可以看成是 A的猝滅劑,也可以把A看成是Q的敏化劑。學科套用
 相關書籍
相關書籍合成化學中的套用
由於吸收給定波長的光子往往是分子中某個基團的性質,所以光化學提供了使分子中某特定位置發生反應的最佳手段,對於那些熱化學反應缺乏選擇性或反應物可能被破壞的體系更為可貴。光化學反應的另一特點是用光子為試劑,一旦被反應物吸收後,不會在體系中留下其他新的雜質,因而可以看成是“最純”的試劑。 如果將反應物固定在固體格子中,光化學合成可以在預期的構象(或構型)下發生,這往往是熱化學反應難以做到的。例如馬來酸與富馬酸的二聚體的固態光合成,以及在冠醚和β-環糊精中的光定向合成,都獲得成功。
大氣中的光化學
地球與行星的大氣現象, 如大氣構成、極光、輻射禁止和氣候等,均和大氣的化學組成與對它的輻照情況有關。地球的大氣在地表上主要由氮氣與氧氣組成。但高空處大氣的原子與分子組成卻很不相同,主要和吸收太陽輻射後的光化學反應有關。大氣污染過程包含著極其豐富而複雜的化學過程,用來描述這些過程的綜合模型包含著許多光化學過程。如棕色二氧化氮在日照下激發成的高能態分子,是氧與碳氫化物鏈反應的引發劑。又如氟碳化物在高空大氣中的光解與臭氧禁止層變化的關係等都是以光化學為基礎的(見環境光化學)。
學科間區別
光化學過程是地球上最普遍、最重要的過程之一,綠色植物的光合作用,動物的視覺,塗料與高分子材料的光致變性,以及照相、光刻、有機化學反應的光催化等,無不與光化學過程有關。近年來得到廣泛重視的同位素與相似元素的光致分離、光控功能體系的合成與套用等,更體現了光化學是一個極活躍的領域。但從理論與實驗技術方面來看,在化學各領域中,光化學還很不成熟。
光化學反應與一般熱化學反應相比有許多不同之處,主要表現在:①加熱使分子活化時,體系中分子能量的分布服從玻耳茲曼分布;而分子受到光激活時,原則上可以做到選擇性激發(能躍值的選擇、電子激發態模式的選擇等),體系中分子能量的分布屬於非平衡分布。所以光化學反應的途徑與產物往往和基態熱化學反應不同。②只要光的波長適當,能為物質所吸收,即使在很低的溫度下,光化學反應仍然可以進行。
